在第二场文献导读的环节中,南昌大学第一附属医院博士研究生刘少正(导师:张青教授)分享了2021年发表在The Lancet Oncology (IF=35.4)上的《卡博替尼治疗放射性碘难治性分化型甲状腺癌 (COSMIC-311试验):一项随机、双盲、安慰剂对照、3期临床试验》。本研究的通讯作者是来自美国宾夕法尼亚大学Abramson癌症中心罕见癌症和个体化治疗中心主任Marcia S Brose。她是DECISION研究的全球联合PI, SELECT 研究的共同研究者,EXAM(卡博替尼治疗甲状腺髓样癌)III期试验的共同研究者,维莫非尼在RAIR-DTC国际多中心II期研究的PI。上述研究分别发表在《柳叶刀》、《临床肿瘤学》、《新英格兰医学》等期刊,促成了FDA批准用于治疗放射性碘难治性分化型甲状腺癌(RAIR-DTC)或甲状腺髓样癌。


研究背景
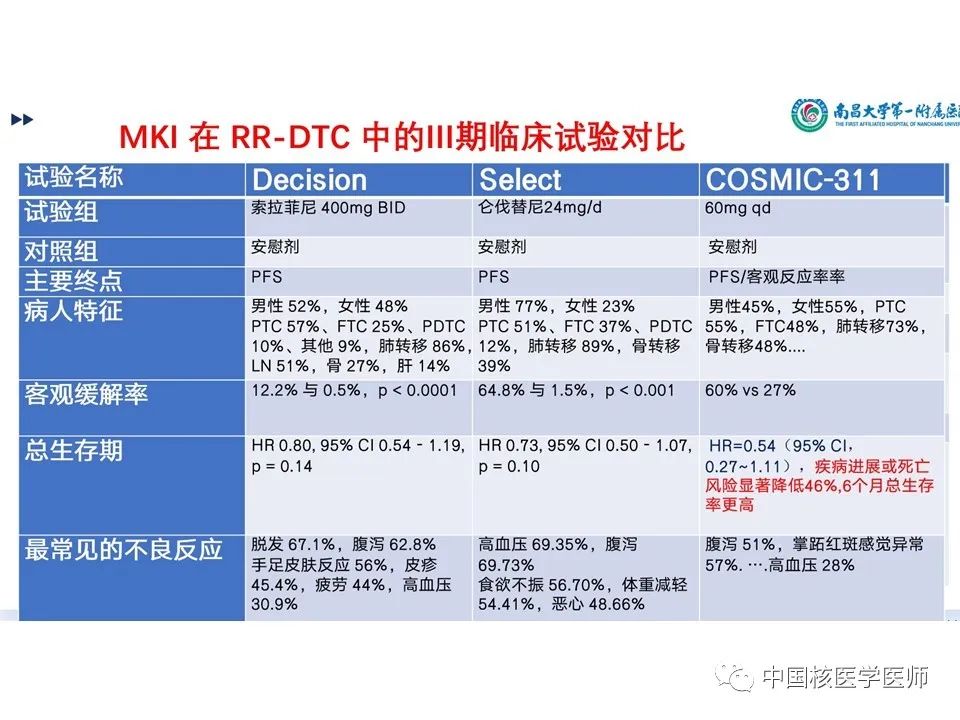
分化型甲状腺癌(DTC)占新诊断甲状腺癌的90–95%。此类癌症若进行积极监测、手术和放射性碘治疗,患者的预后一般相对良好。然而15%的患者发生放射性碘难治性转移性疾病,生存期大大下降。既往的两项RAIR-DTC的安慰剂对照3期试验:DECISION试验中在既往未接受血管内皮生长因子受体(VEGFR)靶向治疗的患者中,索拉非尼的无进展生存率和客观缓解率得到改善;SELECT试验中在既往接受或未接受VEGFR靶向治疗的患者中,使用仑伐替尼可提高无进展生存率和客观缓解率。虽然大多数RAIR-DTC患者最初使用索拉非尼或仑伐替尼能实现疾病控制,但大多数患者会产生治疗耐药并出现疾病进展。一线治疗后疾病进展后的RAIR-DTC患者的中位总生存期(OS)小于 5 年。
卡博替尼(cabozantinib),能抑制MET、VEGFR1、VEGFR2、VEGFR3、ROS1、RET、AXL、NTRK、KIT等9个靶点,目前在肾癌、肝癌、软组织肉瘤、非小细胞肺癌、前列腺癌、乳腺癌、卵巢癌等多种实体瘤中证实了较好的疗效,对于骨转移的控制效果尤其突出。在此项研究前已被批准用于甲状腺髓样癌患者,并且在有或无VEGFR靶向治疗的RAIR-DTC患者的1期和2期研究中也显示出临床益处。此次名为COSMIC-311的临床试验,是一项全球性、多中心、随机、双盲、安慰剂对照的3期试验,用于评估卡博替尼对之前接受过VEGFR靶向治疗的RAIR-DTC患者的疗效与安全性。
研究方法
来自25个国家、164个医疗机构的患者,最终入选总人数187名。患者被随机分配(2:1)接受卡博替尼或匹配的安慰剂,前100名随机分配的患者(卡博替尼组67名,安慰剂组33名)。患者被随机分配(2:1)接受卡博替尼或匹配的安慰剂。随机化按之前是否接受了仑伐替尼治疗(是 vs 否)和年龄(≤65 vs >65 岁)进行分层。随机方案使用区块大小为 6 的排列区组和交互式语音-网络应答系统集中分配。随机化时间表的生成被分配给一个独立于研究的临床研究组织。由临床研究组织生成的实时时间表上传到一个安全的服务器,供应商负责交互式语音-网络响应服务。研究人员无法访问实时时间表、块或块大小的主列表,直到获得授权和记录揭盲(2021 年 4 月 16 日)。唯一药包编号预印在每个瓶子或包装上,并通过交互式语音-网络响应系统分配给患者,以确保患者、研究人员、现场工作人员和研究赞助商无法知晓治疗分配方案。研究人员可以要求在由盲法独立放射学委员会 (BIRC) 确认的放射学进展时揭盲。
纳入标准:⑴年龄16岁以上,确诊为DTC,根据(RECIST)版本1.1的反应评估标准,有可测量的疾病。⑵之前接受过仑伐替尼或索拉非尼治疗等TKI治疗,但不限于二者,最多使用2种。在使用VEGFR TKI治疗期间或之后,按照RECIST版本1.1疾病影像学进展。⑶东部肿瘤合作组(ECOG)体力状态评分为0或1,适当器官和骨髓功能,必须接受甲状腺素抑制治疗,TSH低于参考范围下限或低于0.50mIU/L。
排除标准:(1)先前使用选择性BRAF抑制剂或卡博替尼进行治疗,其他免疫抑制治疗。(2)使用口服抗凝剂或血小板抑制剂进行治疗(不包括低剂量阿司匹林和低剂量低分子量肝素)。(3)存在未经治疗的脑转移,以及未控制的严重并发症。
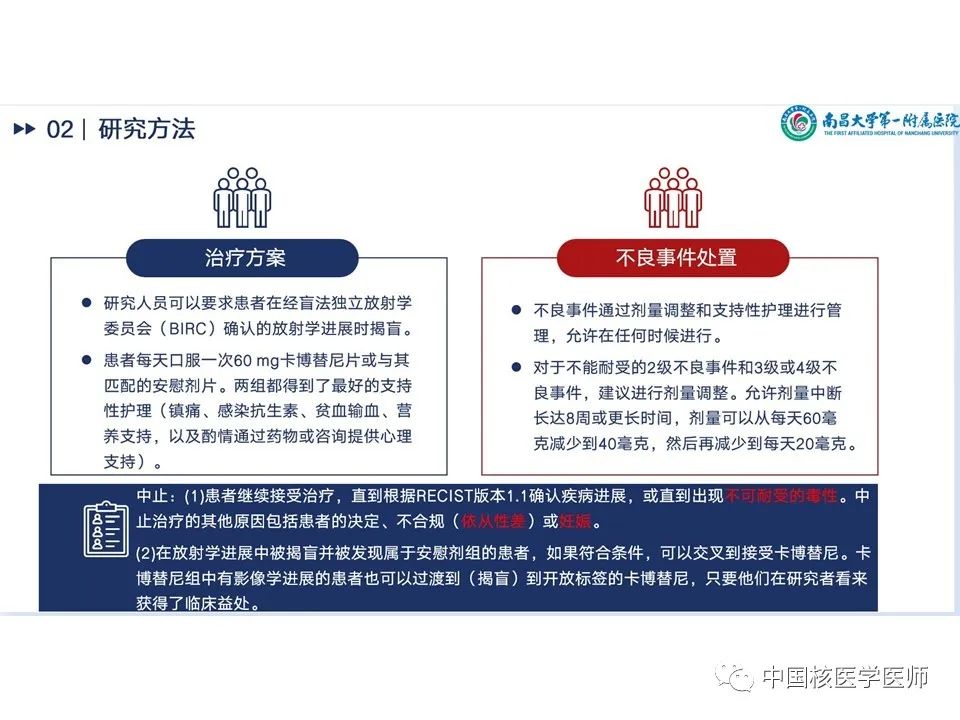
研究方案:研究人员可以要求患者在经盲法独立放射学委员会(BIRC)确认的放射学进展时揭盲。患者每天口服一次60 mg卡博替尼片或与其匹配的安慰剂片。两组都得到了最好的支持性护理(镇痛、感染抗生素、贫血输血、营养支持,以及酌情通过药物或咨询提供心理支持)。(1)甲状腺球蛋白评估:基线检查、第5周、第9周、然后每8周评估一次血清甲状腺球蛋白。实验室检测包括血液学、生化、凝血、尿液和甲状腺功能测试开始每2周进行一次,从第9周之后每4周进行一次。(2)研究人员和BIRC根据RECIST版本1.1对图像进行评估:基线检查后,每8周通过MRI或CT评估肿瘤反应和进展,持续1年,然后改为每12周进行一次。(3)在第9周之前,每2周评估一次安全性,之后每4周评估一次,并在治疗中断后30天进行治疗后随访。研究人员根据美国国家癌症研究所不良事件通用术语标准第 5 版对不良事件进行了严重程度分级。在最后一次治疗后随访后,每 12 周评估一次OS。 不良事件处置:不良事件通过剂量调整和支持性护理进行管理,允许在任何时候进行。对于不能耐受的3级或4级不良事件,建议进行剂量调整。允许剂量中断长达8周或更长时间,剂量可以从每天60毫克减少到40毫克,然后再减少到每天20毫克。
中止标准:(1)患者继续接受治疗,直到根据RECIST版本1.1确认疾病进展,或直到出现不可耐受的毒性。中止治疗的其他原因包括患者的决定、不合规(依从性差)或妊娠。(2)在放射学进展中被揭盲并被发现属于安慰剂组的患者,如果符合条件,可以交叉到接受卡博替尼。卡博替尼组中有影像学进展的患者也可以过渡到(揭盲)到开放标签的卡博替尼,只要他们在研究者看来获得了临床益处。
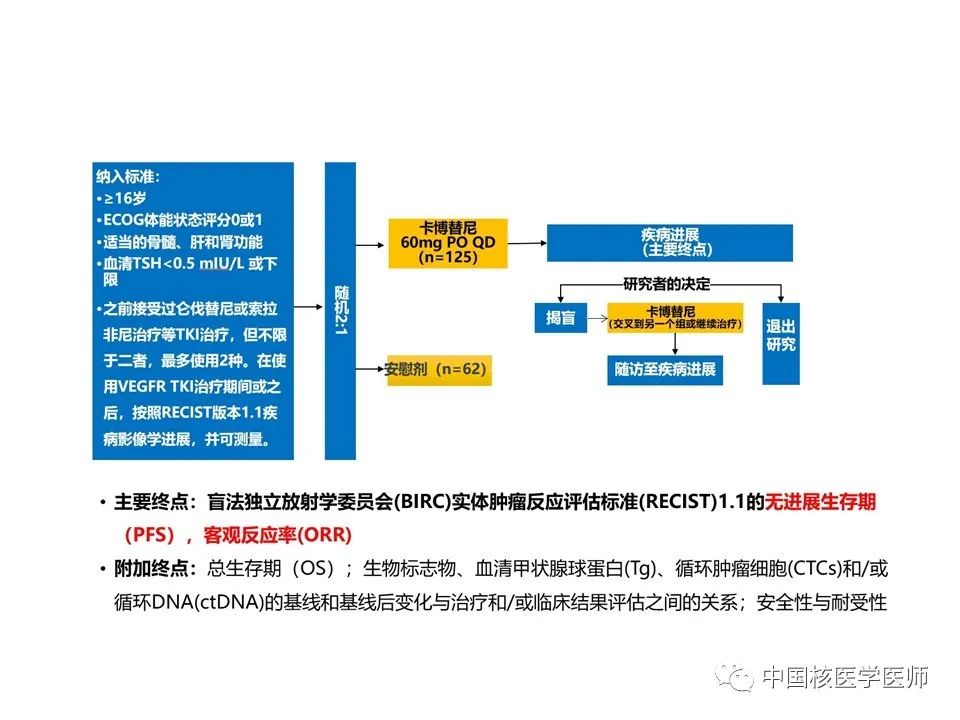
研究终点: 主要研究终点:基于BIRC的评估,前100名随机分配患者的ORR客观缓解率(客观缓解率意向治疗[OITT]人群)和所有随机分配患者的PFS无进展生存期(意向治疗[ITT]人群)。客观缓解率:OITT人群中至少随访6个月后按照RECIST版本1.1确认CR完全或PR部分缓解的患者比例。总生存期:从随机分组到因任何原因死亡的时间。至少28天后确认的首次客观反应记录到疾病进展或因任何原因死亡的最早的时间,以及应答持续时间及血清甲状腺球蛋白浓度的变化(定义为根据基线、第5周第1天和第9周第1天的评估得出的血清甲状腺球蛋白浓度的最佳下降百分比),并在OITT和ITT人群中进行评估。疾病稳定率:患者在至少16周的时间内达到确切反应(完全或部分)或稳定疾病的比例。对至少接受一剂试验方案的所有患者(安全人群)进行安全性和耐受性评估。

统计学分析:数据整理后,应用SAS 9.4版统计软件进行统计学分析。(1)Bonferroni程序控制I类错误;(2)采用Fisher精确检验对OITT人群中由BIRC评估的客观缓解率进行比较,α为1%。客观缓解率的95%可信区间使用精确的二项法进行估计。(3)对每个RECIST 1.1的客观缓解率进行了预先指定的敏感性分析。作为支持性分析,生成了显示自基线检查以来靶病变肿瘤最大减少百分比或最小增加百分比的瀑布图。(4)Kaplan-Meier方法用于估计所有时间-事件终点的中位随访时间和相关95%CI,包括反应持续时间和无进展生存期。还提供了预先指定时间点的Kaplan-Meier生存估计值。(5)用算术方法估计中位反应时间,无进展生存率的主要终点使用96%可信区间进行推断。(6)无进展生存率采用分层对数秩检验,风险比(HR)采用分层Cox比例风险模型进行估计。通过视觉评估比例风险假设,并通过治疗效果的逐时效应交互试验进行评估。

研究结果
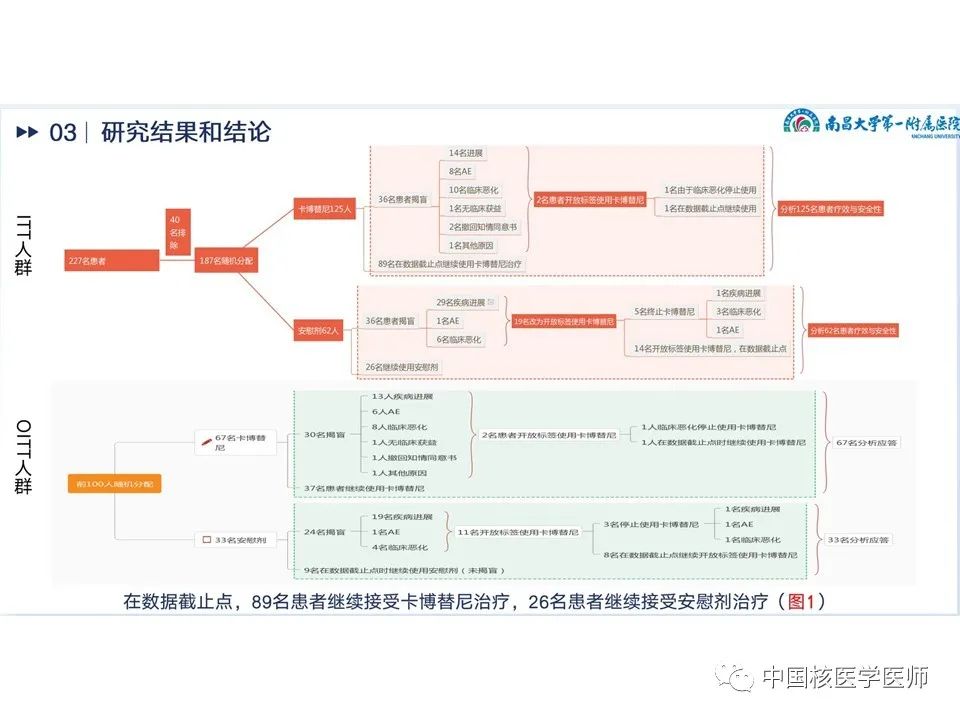
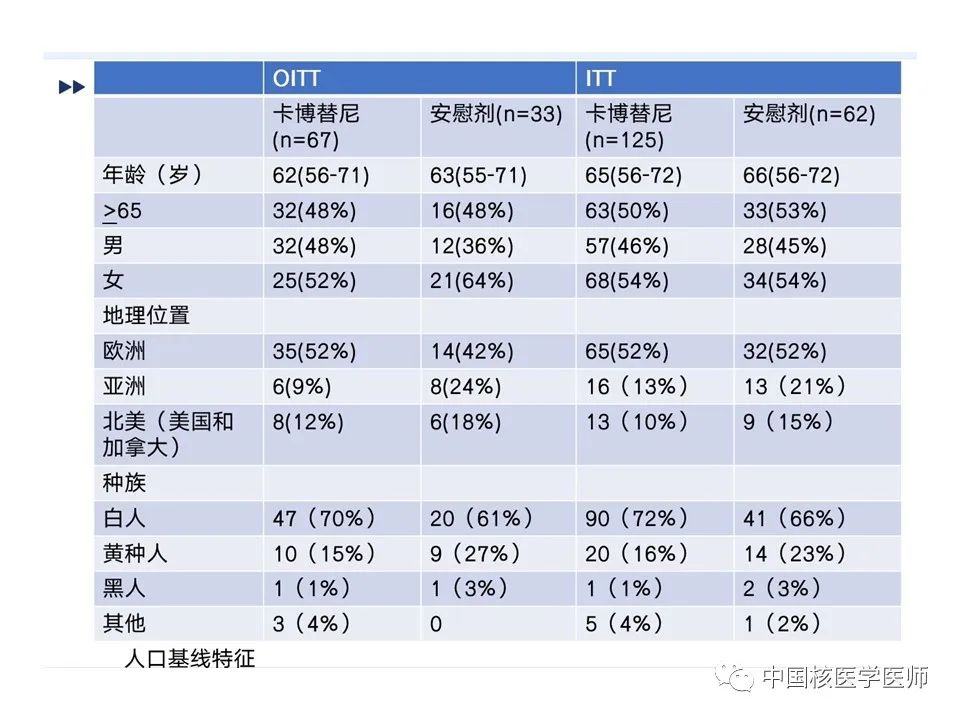
在数据截止点,89名患者继续接受卡博替尼治疗,26名患者继续接受安慰剂,具体见路线图(图9),治疗中止的最常见原因是两个治疗组的疾病进展。卡博替尼组中的两名患者和安慰剂组中的 19 名患者在 BIRC 的放射学进展情况下都被揭盲,并过渡到接受开放标签的卡博替尼治疗。基线时人口学特征见(图10)。

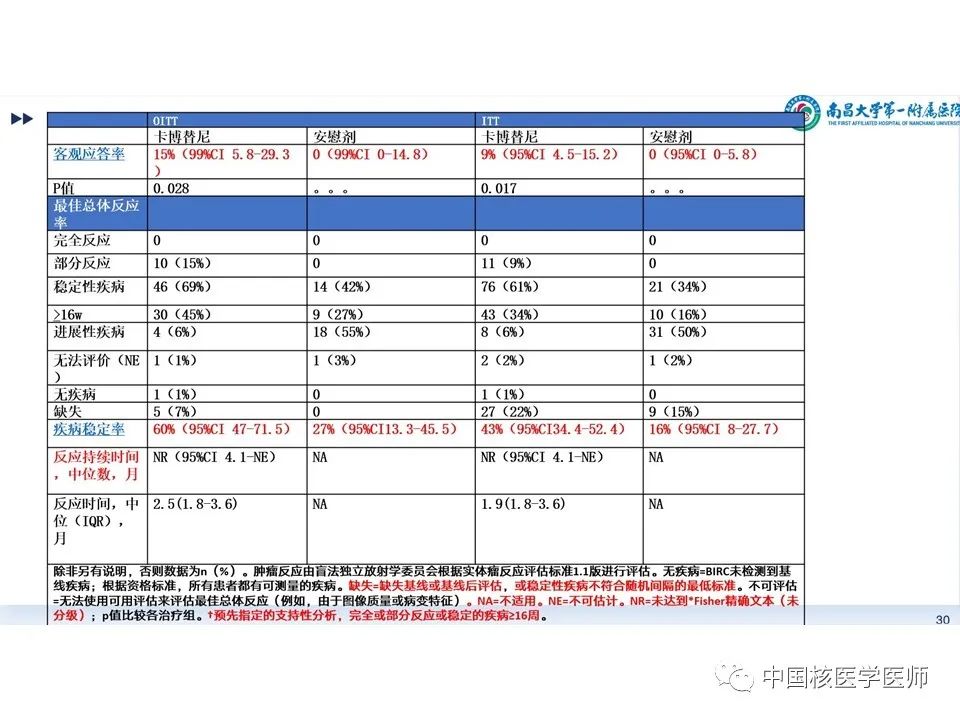
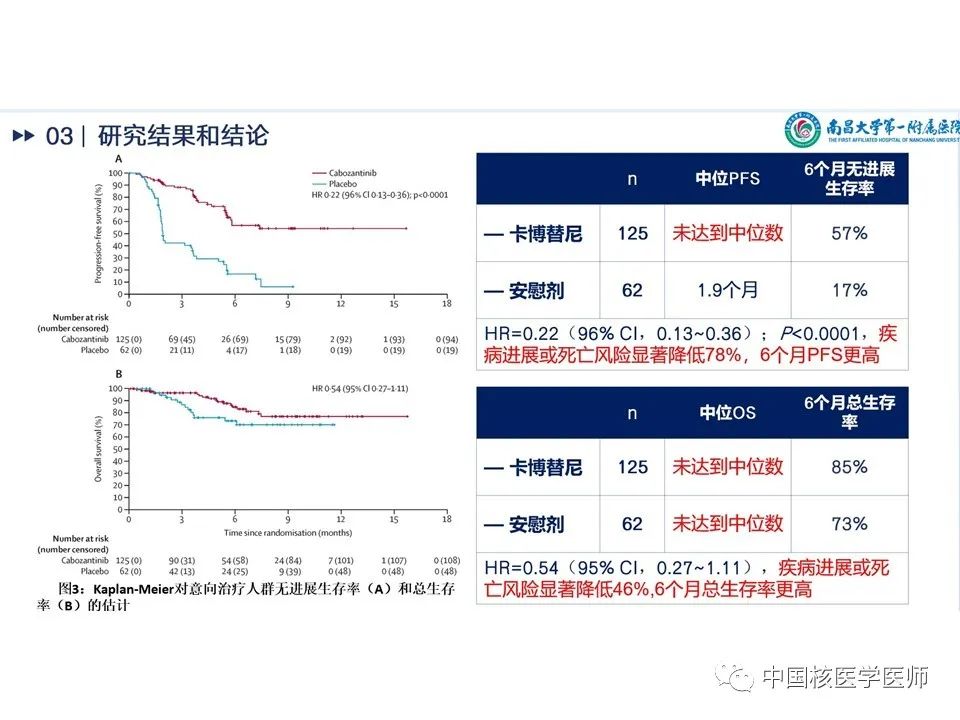
主要结果见(图11):(1)截至2020年8月19日,所有意向治疗人群(intention-to-treat [ITT] population)的中位随访时间为6.2个月,在前100名入组、计划评估客观缓解率(ORR)的ITT人群(OITT)中,中位随访时间为8.9月。(2)在前100名入组的OITT人群中,卡博替尼组的客观缓解率为15%(10/67),而安慰剂组为0例(p=0.028),但尚未达到预先指定的显著性水平。卡博替尼组10名患者目前均为部分缓解,在数据截止时其中9人仍持续缓解。(3)基线目标病变评估,卡博替尼组76%(44/58)目标病变减少,安慰剂组仅为29%(9/31)。(4)疾病稳定率的预定终点如表所示,OITT人群:卡博替尼组60%(95%CI 47-71.5),安慰剂27%(95%CI13.3-45.5),P=0.028。ITT人群:卡博替尼组9%(95%CI 4.5-15.2),安慰剂0(95%CI 0-5.8),P=0.017。
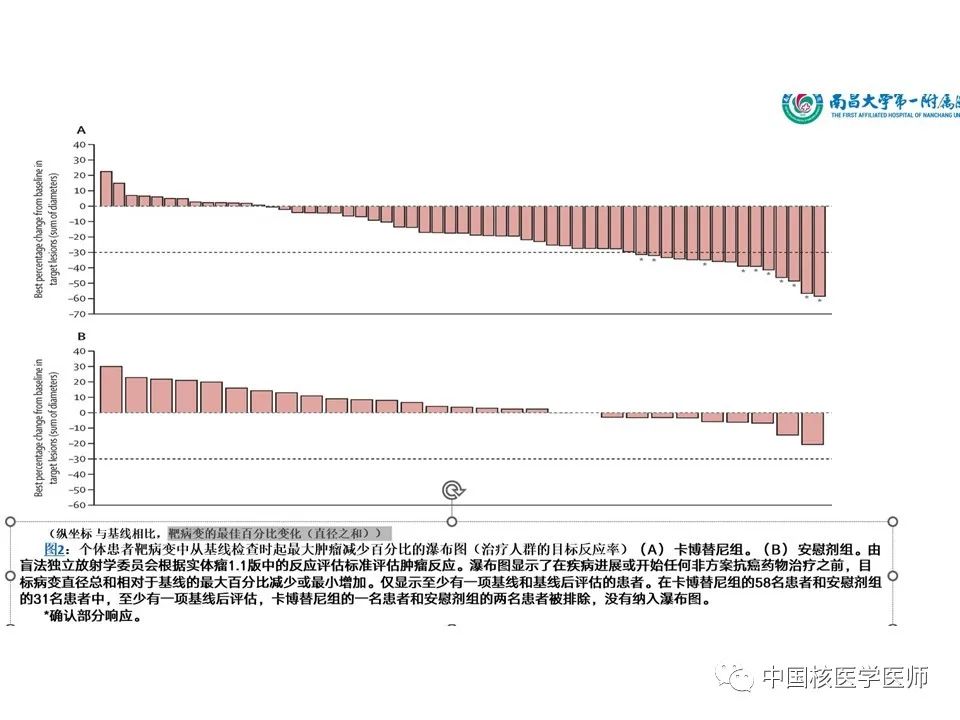
患者靶病变中从基线检查时起最大肿瘤减少百分比的瀑布图(治疗人群的目标反应率)(A) 卡博替尼组。(B) 安慰剂组。由BIRC根据实体瘤1.1版中的反应评估标准评估肿瘤反应。瀑布图显示了疾病进展前目标病变直径总和相对于基线的最大百分比减少或最小增加。仅显示至少有一项基线和治疗后评估的患者。在卡博替尼组的58名患者和安慰剂组的31名患者中,至少有一项基线后评估,卡博替尼组的一名患者和安慰剂组的两名患者被排除,没有纳入瀑布图(图12)。
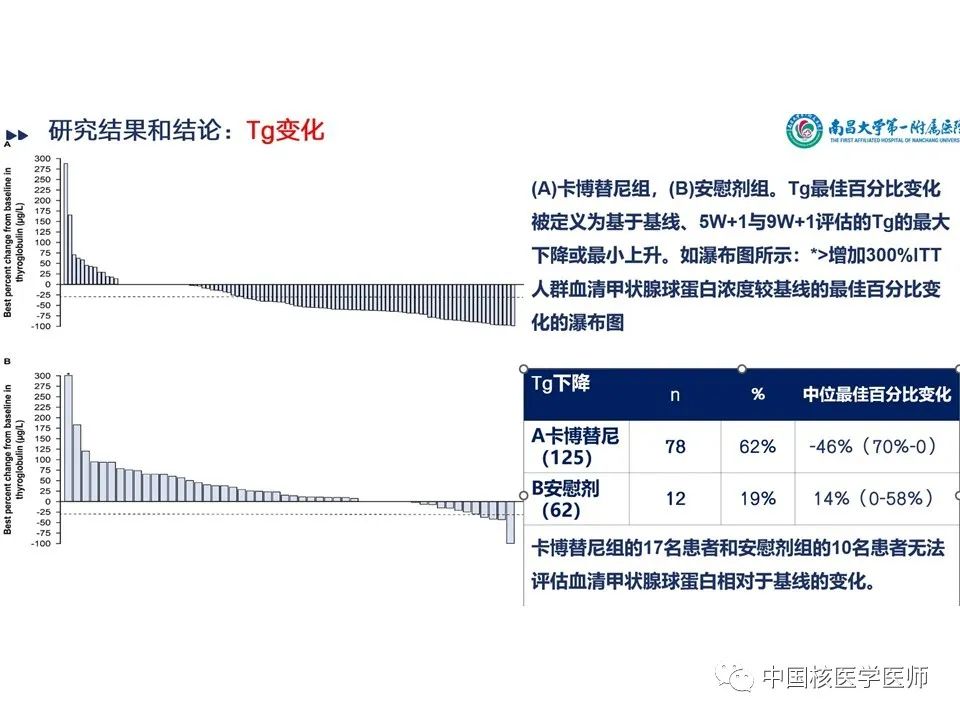
甲状腺球蛋白的变化:(A)卡博替尼组,(B)安慰剂组。Tg最佳百分比变化被定义为基于基线、5W第一天与9W第一天评估的Tg的最大下降或最小上升。如瀑布图所示:ITT人群血清甲状腺球蛋白浓度较基线的最佳百分比变化的瀑布图见(图13)
Kaplan-Meier对ITT无进展生存期(A)和总生存期(B)的估计见(图14)分析PFS,试验组与对照组相比疾病进展或死亡风险显著降低78%,HR=0.22(96% CI,0.13~0.36);P<0.0001,6个月PFS更高;分析OS,试验组疾病进展或死亡风险显著降低46%,HR=0.54(95% CI,0.27~1.11),6个月总生存率更高。
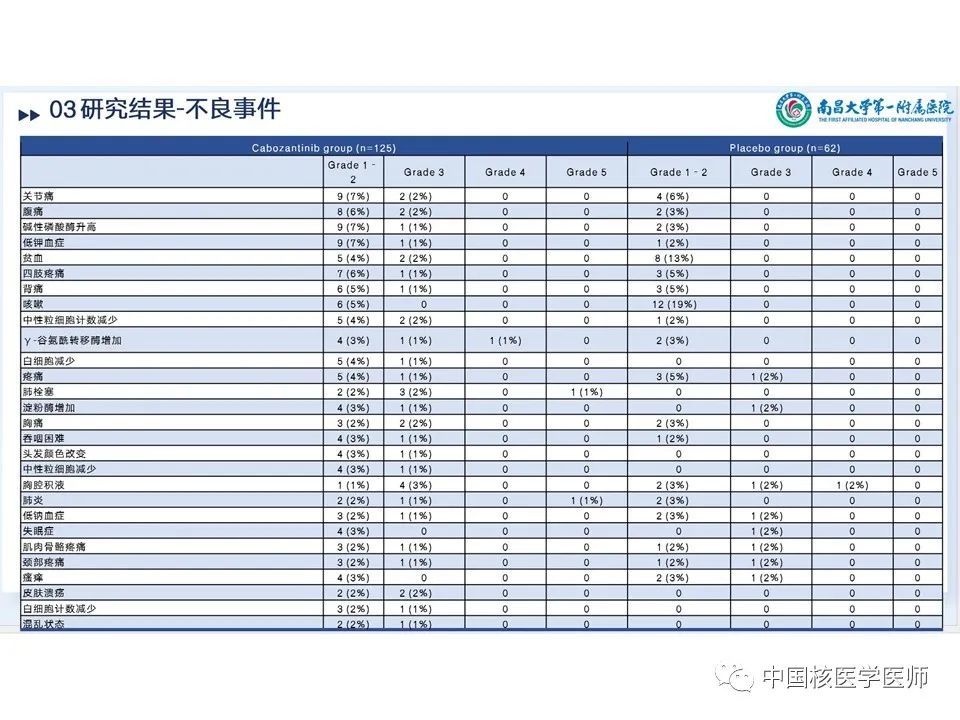
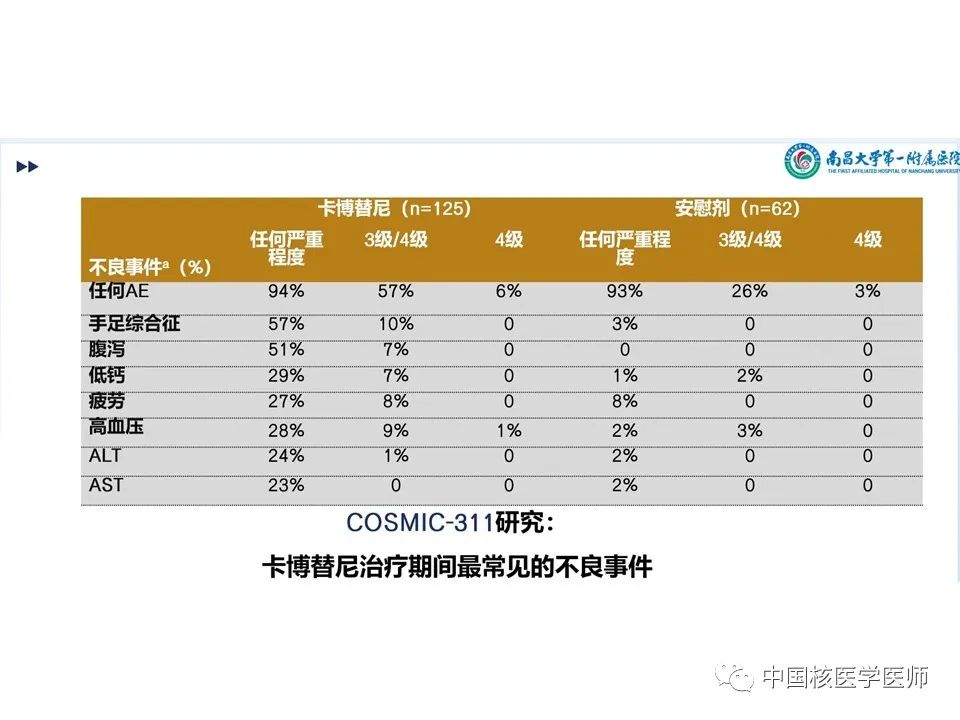
卡博替尼组用药持续时间四分差 (IQR)为4.4个月,安慰剂组为2.3个月。卡博替尼组日平均剂量IQR 42mg,因不良反应(AE)而改变剂量占78%, 90例(72%)因AE仍保持剂量不变持续时间IQR 10.4个月,70例(56%)进行了减量。治疗期间出现AE而停药的占5%。不良反应:剂量减少:卡博替尼组:手掌-足底红斑感觉障碍(手足综合征)(125例中24例,占19%)、腹泻(13例,占10%)和疲劳(9例,占7%)。安慰剂组:导致剂量减少的不良事件包括疲劳、呼吸困难、吞咽困难和瘙痒(62例中有1例)。停药:疲劳(n=2)、关节痛(n=1)、腹泻(n=1)、高钙血症(n=1)、高血压(n=1)、大肠穿孔(n=1)、肝功能试验增加(n=1)、肌痛(n=1)和肾功能损害(n=1);一名患者可能不止一种治疗相关不良事件。后续治疗:卡博替尼组125人中有3人(2%)使用后续全身抗癌治疗,安慰剂组62人中有4人(6%)使用后续全身抗癌治疗。此外,安慰剂组19名(31%)患者跨组接受卡博替尼治疗。博替尼组 125 例患者中有 117 例(94%)和安慰剂组 62 例患者中有 58 例(93%)发生了任何因果关系和任何级别的不良事件,125 例患者中有 71 例(57%)发生了 3 级或 4 级不良事件,安慰剂62 例中有 16 例 (26%) 。卡博替尼4 级不良事件发生7 例 (6%) ,安慰剂62 例中发生 2 例 (3%) 中(图15、图16)。最常见的3 级或 4 级不良事件包括掌跖红斑感觉异常(125 例中的 13 例 [10%] 卡博替尼 vs 安慰剂 0%)、高血压(11 [9%] vs 2 [3%])、疲劳(10 [8%] vs 0%)、腹泻(9 [7%] vs 0%)和低钙血症(9 [7%] vs 1 [2%])。 卡博替尼组的患者20 例(16%)发生严重的治疗相关不良事件,安慰剂组发生1例(2%)(文章附录第 13 页)。最后一次给药后至 30 天内共有 16 人死亡:卡博替尼组 125 例中有 9 例(7%),安慰剂组 62 例中有 7例(11%)。这些 5 级事件均被认为与治疗无关。在卡博替尼组中,5 例患者死于疾病进展或甲状腺癌。其他4例患者有以下导致死亡的 5 级不良事件:动脉出血、心肺骤停、肺炎和肺栓塞。在安慰剂组中,4例患者死于疾病进展或甲状腺癌。其他3例患者有以下导致死亡的 5 级事件:心脏骤停、脑血管意外和一般身体健康恶化。
研究结论
(1)COSMIC-311是第一个评估RR-DTC VEGFR靶向TKI治疗后进展的随机、双盲、全球多中心3期研究,该研究用于评估先前接受过仑伐替尼或索拉菲尼以及最多两种VEGFR TKI治疗的患者。(2)卡博替尼现已被批准用于多种类型的晚期实体瘤,包括甲状腺髓样癌,以及在先前接受VEGFR TKI治疗的亚组中,与卡博替尼相关的无进展生存益处得以维持。(3)卡博替尼组靶病变有所减少,疾病稳定率的提高,显著的无进展生存获益。卡博替尼显著延长了先前接受VEGFR靶向治疗的进展的RAIR-DTC患者的无进展生存期,显著降低了疾病进展或死亡的风险。在OITT人群中,卡博替尼组客观缓解率更高。(4)安全性分析是可控的,并且与卡博替尼的已知安全性分析一致。这些发现支持卡博替尼作为一种新的治疗选择。 并对3种已经获批的药物的3期试验进行了拓展对比见(图17)
研究局限性
研究的潜在缺点包括随访时间短,需要对无进展生存期进行支持性分析,并进行额外的随访。尽管亚组分析支持卡博替尼在各种预定义的患者亚组中的应用,但其中一些亚组的患者人数相对较少。此外,总体生存数据的解释受到随访时间短以及患者从安慰剂组调到卡博替尼组的交叉的限制。
文献的启迪
(1)研究思路,选取患者均为使用过靶向药物后进展的,为使用过TKI患者带来新的治疗方案;(2)设计严谨的分层分组随机化方案,降低实验结果偏倚;(3)入选标准与排除标准严谨细致、统计学分析方法都对我们在今后的科研工作中有一个很好范例。(4)针对基因突变及信号传导通路的靶向治疗药物及多学科治疗为此类甲状腺癌患者带来了福音,但由于存在一定不良反应,故用药患者的选择及适应证的把握存在困难; (5)用药前后患者的评估、长期随访的评价及撤药原则也缺乏统一标准;(6) 此外,选择靶向药物的时机有待进一步研究。
总结与点评
首先,高再荣教授对此文献导读进行了梳理与点评。此研究设计方案严谨规范,为我们今后临床研究设计起到了很好的范例作用。研究显示卡博替尼作为多靶点抑制剂,显著延长了先前接受VEGFR靶向治疗的进展的RAIR-DTC患者的无进展生存期,显著降低了疾病进展或死亡的风险,且药物不良反应相对可控。同时本研究也存在的一定局限,比如随访时间比较短、疗效评价主要依靠老的评价体系,比如血清学Tg和影像学,缺乏基因分子标志物的检测评估。难治性甲状腺癌在临床中选择的治疗方案并不多,今后应加强靶向药物与靶向药物联合、靶向药物与免疫抑制剂联合、靶向药物与碘-131联合、靶向药物与碘-125联合的研究,可能为RAIR-DTC患者提供新的治疗选择。随后张青教授进行点评,指出青年强则科研强,作为年青医生和研究生一定要加强科研能力的学习,由中国医师协会核医学医师分会青年委员会举办的《文献导读》是一个很好的学习平台。今天文献导读的内容是卡博替尼治疗RAIR-DTC :一项随机、双盲、安慰剂对照、3期临床试验的研究,卡博替尼为先前接受VEGFR靶向治疗进展的患者提供了新的治疗手段,这项经典的研究促成了2021年被美国FDA获批用于RAIR-DTC,核医学医师要及时掌握最新的技术与进展,也要规范化开展分子靶向治疗,但我们也应该看到多靶点的分子靶向治疗的缺点,碘-131作为分化型甲状腺癌传统和最经典的“靶向”治疗,应该充分挖掘其在DTC中的应用价值,继续加强多学科、多技术协同诊疗作用。会议主持张庆副教授进行了点评分析,根据这3个经典临床试验的事后检验分析,影响RR-DTC MKI 治疗结果的因素涉及患者年龄、组织学类型、肿瘤位置、转移部位、甲状腺球蛋白和甲状腺球蛋白倍增时间、肿瘤体积倍增时间以及患者的症状等,这对临床何时启动MKI治疗以及预测疗效均有指导价值。也为研究生们开展研究提供了新的思路。最后,青委副主委李囡教授进行了总结,大家一起期待下一次的文献导读活动。