177Lu-FAP-2286肽靶向放射性核素治疗的
可行性、生物分布及初步剂量测定:
首次人体试验结果
摘要:成纤维细胞活化蛋白(FAP)是许多恶性肿瘤有希望的诊断和治疗靶点。FAP-2286是一种与FAP结合的肽,可通过放射性核素标记实现诊疗一体化。本研究为177Lu-FAP-2286进行肽靶向放射性核素治疗(PTRT)的首次人体试验结果。方法: 11例晚期胰腺癌、乳腺癌、直肠癌、卵巢癌患者经68Ga-FAP-2286或68Ga-FAPI-04 PET/CT确认摄取后,接受177Lu-FAP-2286 PTRT。结果: 177Lu-FAP-2286(5.8±2.0 GBq; 2.4-9.9 GBq)给药耐受性良好,所有患者都未发现不良症状或临床可检测的药理作用。全身有效剂量为0.07±0.02 Gy/GBq (0.04-0.1 Gy/GBq)。肾脏和红髓的平均吸收剂量分别为1.0±0.6 Gy/GBq (0.4-2.0 Gy/GBq)和0.05±0.02 Gy/GBq (0.03-0.09 Gy/GBq)。177Lu-FAP-2286大量的摄取和长时间的肿瘤滞留带来高肿瘤吸收剂量,如骨转移3.0±2.7 Gy/GBq (0.5-10.6 Gy/GBq)。未观察到4级不良事件。3例患者发生3级事件: 1例全血细胞减少,1例白细胞减少,1例疼痛发作; 3例报告疼痛反应。结论: 177Lu-FAP-2286 PTRT可广泛应用于多种肿瘤,其耐受性较好,副作用可接受,并表现出较长的放射肽滞留。有必要进行前瞻性临床研究。
关键词: 177Lu-FAP-2286;腺癌;成纤维细胞活化蛋白;首次人体试验;肽靶向放射性核素治疗
方法(部分)
患者资料
5例侵袭转移性胰腺癌患者(1-5号),4例乳腺癌患者(6-9号),1例卵巢癌患者(10号)和1例直肠癌患者(11号)接受177Lu-FAP-2286的肽靶向放射性核素治疗(PTRT)为姑息治疗。在治疗前,通过68Ga-FAP-2286(n=9)或68Ga-FAPI-04(n=2)PET/CT确认转移灶FAP表达。肿瘤与肝脏SUV比值需>3,以确保转移灶显著的FAP表达和肝脏的低生理性摄取。
PTRT治疗后,患者接受随访至死亡或病情进展。转移出现在淋巴结(n=6)、肺(n=3)、胸膜(n=1)、腹膜(n=3)、肝(n=8)、骨(n=5)和弥漫性骨髓(n=2)。6例患者接受了原发肿瘤手术,8例接受了化疗,3例接受了其他放射性核素治疗,2例接受了免疫检查点抑制剂治疗,1例接受了聚腺苷二磷酸核糖聚合酶抑制剂治疗。9号患者在PTRT开始前4周结束化疗,2号和7号患者在PTRT开始前2周结束化疗。10号患者提前4周接受了最后一次纳武利尤单抗治疗。2例患者(1号和3号患者)拒绝任何其他形式治疗,如手术或化疗,5号患者被认为不适合化疗(表1)。
治疗方案
177Lu-FAP-2286在5-10分钟内完成静脉给药。所有患者均表现为疾病进展与高肿瘤负荷,需要高剂量(所需放射活度)以控制肿瘤。如有必要,不仅根据患者的一般情况、血液学结果和肾功能,而且根据肿瘤分布,即红骨髓受累的情况,调整注射活度。例如,一个预先存在的2级贫血需要减少177Lu-FAP-2286使用量。当患者同意并且情况允许进一步治疗时,在8周后进行额外的周期治疗。1例接受单个周期治疗,9例接受2个周期治疗,1例接受3个周期治疗。
为预防恶心,在给予177Lu-FAP-2286之前静脉注射3 mg格拉司琼。在放射性药物应用后2小时内给予1升平衡电解质溶液,并加入20 mg呋塞米。在治疗前、治疗中和治疗后对患者症状和生命指征进行监测。患者特征、肿瘤特征以及所有前期治疗均被记录。每周期PTRT前和随访期间,均测定全血计数、肝肾功能、肌酸激酶水平、尿酸水平和电解质水平,以及肿瘤相关标志物如癌症胚胎抗原、CA15-3、CA19-9和CA125的水平。血液学毒性根据不良事件通用术语标准5.0进行分级。
剂量测定方案
每位患者从注射后0.5小时开始(给177Lu-FAP-2286后至膀胱排空前),至少获得5次连续的平面全身扫描研究和1次区域SPECT/CT研究。由于患者在第一次扫描前不允许排空膀胱,所以在注射药物后立即获得的全身计数被定义为给药活度的100%。在随后的扫描中,全身计数则以给药活度的百分比表示。在SPECT图像上手动绘制感兴趣区域,然后用Hermes系统的软件进行分析。源区被定义为显示出明显特异性摄取的器官和转移灶,在每次治疗后的扫描中可以清楚地勾画出来。感兴趣区由同一物理师与核医学医师共同选择,进行病变剂量测定(即在各自器官中具有最高摄取量的病灶)。相比于淋巴结和腹膜病变在全身显像中易受影像重叠的干扰,骨转移和肝转移在全身和SPECT/CT断层扫描上的易探测性以及骨转移的高发性,使其成为肿瘤剂量学的代表性病变。感兴趣区技术被用于确定分析全身和源器官的药代动力学。使用Hermes软件进行 SPECT/CT图像重建和定量分析。分割后,利用源区的SPECT 活性标化平面成像得到的时间-放射性曲线。随后,时间-放射性曲线被拟合到单指数或双指数函数中,以计算有效半衰期和时间积分活度系数。最终使用OLINDA 2.0评估器官和肿瘤的平均吸收剂量。通过与患者近期的CT扫描适配所获体积,国际放射防护委员会成人模型和球体模型分别被用于正常器官和肿瘤病变(都包含在OLINDA 2.0中)的剂量测算。
研究在10个治疗周期中进行了剂量评估:1、4、5、10号患者分别测算了一个周期,6、7、8号患者分别测算了两个周期。治疗后在一下规定时间点进行扫描:注射后立即进行;注射后2-3小时;注射后1、2、3天,以及(病情允许时)注射后10天内的进一步延迟扫描。通过在连续的177Lu-FAP-2286扫描图像上绘制感兴趣区域,确定肾脏和转移瘤(13个骨转移瘤和1个肝转移瘤)的时间-放射性变化。10次评估中,根据多时点采血获取的血液放射性活性,进行了4次红骨髓的平均吸收剂量测算;另外的6次红骨髓平均吸收剂量,则是通过全身放射性活性分布进行测算的。
临床、放射和实验室随访
研究过程中,需要对记录进行严格审查,以了解血液学、胃肠道、肾脏、肝脏或其他不良事件的发生情况。所有患者在治疗后都进行了系统的随访,每2周测定一次相关的实验室参数,第一个PTRT周期前2天完成基线68Ga-FAP-2286 PET/CT和增强CT或MRI。为了确定疗效,在第一个治疗周期后6-8周,所有患者都进行了CT/MRI检查,有10名患者进行了68Ga-FAP-2286 PET/CT检查(5号患者除外)。
结果
耐受性
FAP-2286的平均给药量为290±100μg。平均给药活度为5.8±2.0 GBq。11名患者中没有任何不良反应或临床上可检测到的药理作用,没有观察到与不良事件相关的生命体征或实验室检查结果的明显变化。4号和6号病人报告说治疗后疼痛明显改善,吗啡使用量减少;5号患者在治疗后除了疼痛缓解外,自述体力和生活质量也有改善。
治疗后177Lu-FAP-2286全身扫描和SPECT/CT
对治疗后的全身扫描和SPECT/CT扫描的视觉分析表明,所有患者的肿瘤病灶都有177Lu-FAP-2286的显著摄取和滞留。177Lu-FAP-2286的初始生物分布与治疗前的68Ga-FAP-2286 PET/CT相同。
剂量测定
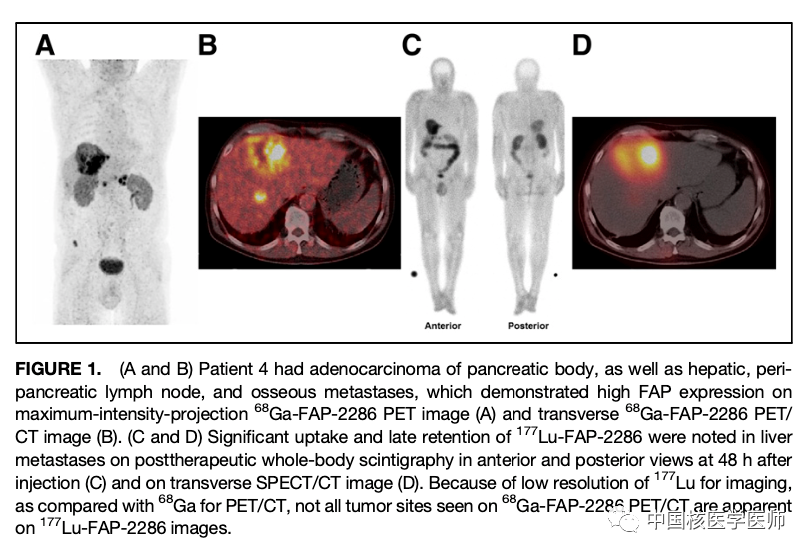
根据177Lu-FAP-2286给药后的试验结果,获得了一系列剂量参数。有效半衰期: 全身35±9小时(25-48小时) ; 肾脏81±51小时(30-161小时) ; 骨转移灶(n=13) ,44±25小时(21-120小时)。平均吸收剂量: 全身,0.07±0.02 Gy/GBq (0.04-0.1 Gy/GBq) ; 肾脏,1.0±0.6 Gy/GBq (0.4-2.0 Gy/GBq) ; 红髓,0.05±0.02 Gy/GBq (范围,0.03±0.09 Gy/GBq) ; 骨转移灶,3.0±2.7 Gy/GBq (0.5-10.6 Gy/GBq)。1例患者(4号患者)肝转移灶的有效半衰期和平均吸收剂量分别为32h 和0.4 Gy/GBq。
不良事件
临床不良事件包括:1级,3、7、9和10号患者在治疗后12小时内出现短期和自限性头痛;2级,9号患者出现中度头痛;3级,2号患者在第二个周期后出现了严重的腹痛,并伴有恶心和呕吐。此外,2号患者在第一个周期后出现的背部左侧与呼吸有关的疼痛明显减少。
3例患者在PTRT后出现新的贫血(1号和4号患者为1级;11号患者为2级)。第二周期后,5号和7号患者原有的1级贫血恶化为2级。第三个周期后,8号患者出现了3级全血细胞减少症(原来为1级-2级),需要输注红细胞和粒细胞刺激因子。5号患者的白细胞减少症从1级进展到2级,6号患者的白细胞减少症从2级加重到3级。PTRT后,3、4、7和11号患者出现了白细胞减少(非3级);在3、7和11号患者中,白细胞减少发生在第一个周期后,并且是可逆的;然而,4号患者发生在第二个周期后,并持续到8周后死亡。9号患者在第一个PTRT周期后6周,白细胞计数从1级白细胞减少恢复正常,绝对血小板计数改善(仍为1级)。
6号患者原先就有慢性肾功能不全(2级),在第一个和第二个PTRT周期后出现了肾功能急性恶化的情况。两次发作都被确诊为肾前性损伤,即肾脏血流灌注不足导致肾脏功能丧失。在肾前性肾损伤中,肾脏本身无任何问题,肾功能在4周内恢复正常,肾小球滤过率始终保持在30 mL/min以上。其余患者的肾脏参数没有明显变化。肝功能参数、尿酸、电解质和肌酸激酶水平未受PTRT影响。
PTRT后的结局
根据RECIST 1.1标准,所有患者在第一个PTRT周期后6-8周进行评估:8号和9号患者病情稳定,其他9例患者病情进展。这些结果也与肿瘤标志物和68Ga-FAP-2286 PET/CT结果(10例患者)相互印证。由于疾病的明显进展,11号患者未进一步接受PTRT治疗。6号患者68Ga-FAP-2286 PET/CT显示反应不一,既显示弥漫性骨转移灶缓解,但又有新发肝转移提示疾病进展(图2)。8号患者在第三个PTRT周期后8周出现病情进展。最终,6例患者在第一个周期的PTRT治疗后2-8个月因疾病进展去世,1例患者因肺炎去世,1例患者自杀。
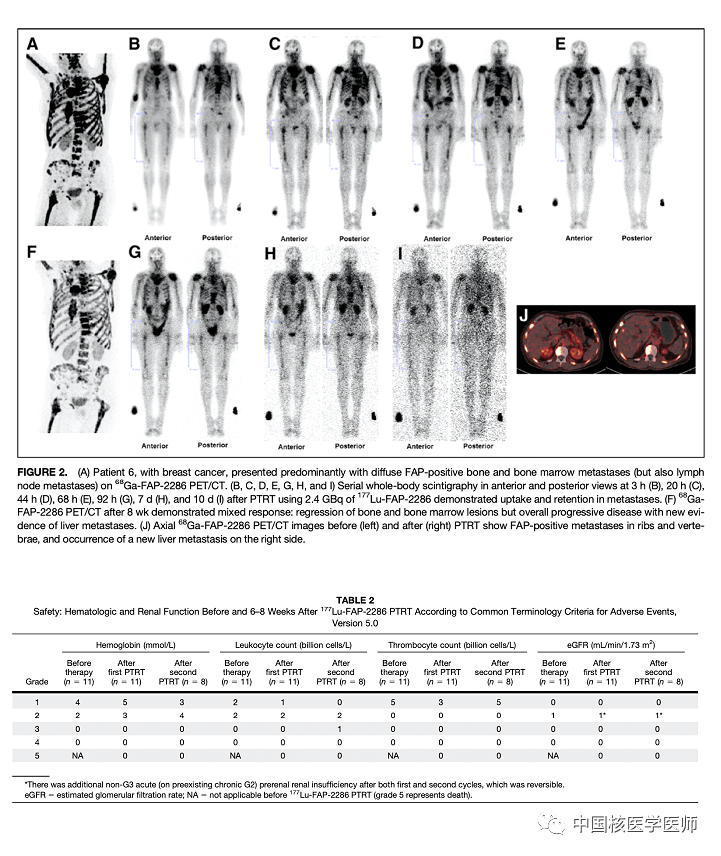
讨论
本回顾性研究首次证明使用新型放射性标记肽177Lu-FAP-2286治疗多种晚期腺癌的可行性。在其他治疗方案无效后,PTRT在终末期胰腺癌、乳腺癌、卵巢癌和结直肠癌患者中以姑息治疗方式进行,其中2例强烈拒绝任何其他治疗,1例被认为不适合化疗。首次人体试验证明了177Lu-FAP-2286 PTRT良好的安全性,仅有少量可控制的严重不良事件。
胰腺癌、乳腺癌、卵巢癌和结直肠腺癌及其转移已被证实在PET/CT上呈FAP阳性。68Ga-FAP-2286或68Ga-FAPI-04在PET/CT上确认了这些恶性肿瘤的FAP表达。治疗后的生物分布图像显示,所有患者不仅对177Lu-FAP-2286有明显的肿瘤摄取,而且放射性药物的滞留时间也很长。相反,以小分子为基础的FAPI示踪剂,特别是FAPI-02和FAPI-04的生物分布研究显示,在肿瘤中清除较快,肿瘤滞留时间也相应缩短,从而限制了它们与177Lu等半衰期较长的治疗性放射性核素结合时的治疗潜力。因此,建议使用半衰期较短的放射性核素来实现基于FAPI的示踪剂治疗。而FAP-2286较长的肿瘤滞留时间使应用较长半衰期的放射性核素(包括177Lu和225Ac)进行治疗成为可能。
这些发现得到了剂量学研究的进一步证实。将177Lu-FAP-2286与之前报道的其他有效的放射性药物(治疗神经内分泌肿瘤的177Lu-DOTATATE和治疗前列腺癌的177Lu-PSMA-617)相比较,其在全身、骨髓和肾脏的吸收剂量具有可比性。值得注意的是,177Lu-FAP-2286在没有肾脏保护的情况下,其肾脏吸收剂量与177Lu-PSMA-617相当,也与肾脏保护剂Lys/Arg共同使用下的177Lu-DOTATATE相当(1.0 Gy/GBq, 0.4-2.0 Gy/GBq) vs. (0.99 Gy/GBq, 0.45-1.6 Gy/GBq) vs. (0.8Gy/GBq, 0.3-2.6Gy/GBq)。177Lu-FAP-2286全身和骨髓吸收剂量(分别为0.07和0.05 Gy/GBq)与177Lu-PSMA-617(分别为0.04和0.03 Gy/GBq)和177Lu-DOTATATE(分别为0.05和0.04 Gy/GBq)相似。骨转移的吸收剂量与Kulkarni等人报告的177Lu-PSMA-617相似[177Lu-FAP-2286为3.0 Gy/GBq (0.5-10.6 Gy/GBq), 177Lu-PSMA-617为2. 9 Gy/GBq],略低于Violet等人报告的177Lu-PSMA-617 [5.3 Gy/GBq (0.4-10.7 Gy/GBq)],尽管其范围有重叠。177Lu-FAP-2286在全身的有效半衰期(35小时)比177Lu-PSMA-617(40小时)和177Lu-DOTATATE(55小时)略短,在肾脏的有效半衰期略长(177Lu-FAP-2286为81小时,177Lu-PSMA-617为42小时,177Lu-DOTATATE为63小时)。因此,尽管个别数值可能有所不同,但177Lu-FAP-2286对健康器官和肿瘤病灶的总体剂量似乎与177Lu标记的其他放射性药物相当。因此,本研究中对患者的剂量分析证明,有必要进行前瞻性临床试验,以确定177Lu-FAP-2286的安全性和有效累积剂量,以及其在多种腺癌患者可能的风险因素。
177Lu-FAP-2286 PTRT有改善侵袭性腺癌的不良症状的潜能。确诊肝转移的4号患者(图1)、弥漫性骨转移的6号患者和新确诊胰腺癌的5号患者,疼痛症状明显减轻。另一方面,在PTRT治疗后不久,9号患者(头痛)和2号患者在第二个周期后出现原有疼痛加剧或短暂地新发局部症状(严重的腹部不适)。放射性核素治疗后短暂的症状爆发现象(闪耀现象)过去也有报道,因此,9号患者和2号患者症状可能与疼痛加剧区域原有的转移灶有关。
对于降低给药活度,可能的原因有:先前存在的红骨髓功能障碍(贫血或全血小板减少症);疾病至红骨髓受累;此外,早前治疗所致肾功能障碍,也可能导致放射性药物全身滞留时间延长,而增加红骨髓的吸收剂量。由于以上种种原因,需限制使用较高的放射性药物活度,以预防潜在的红骨髓功能障碍发生。在6号患者(白细胞减少)和8号患者(全血细胞减少)中观察到3级血液学不良事件,且与弥漫性骨髓受累的影像证据相关。这些不良事件通过间歇性输注填充红细胞和使用粒细胞刺激因子进行骨髓刺激而得到控制。尽管有些患者接受了许多前期治疗,如化疗(2、7和9号患者)、免疫检查点抑制剂治疗(10号患者)、靶向人表皮生长因子受体2的放射受体治疗或针对骨转移的放射性核素治疗(6、7和8号患者),但本研究并未出现严重的血液学毒性。9号患者的骨髓功能不仅没有受到PTRT的影响,反而有所改善(很可能与PTRT开始前2周终止化疗有关)。此外,亦未发现不可逆的器官毒性。6号患者出现的肾前性、急性-慢性肾功能不全可通过静脉输液来缓解,并在1周后恢复正常。
PTRT最可能的作用机制是破坏作为癌症支持系统的成纤维细胞,以及可以引起肿瘤细胞死亡的交叉火力效应。然而,本例研究多数患者疾病进展,因此尚有必要改善治疗策略。提高PTRT疗效的可能措施是缩短治疗的间隔时间或增加给药的放射性。此外,也可以评估与其他方法[如与聚(腺苷二磷酸盐-核糖)聚合酶抑制剂或免疫检查点抑制剂等靶向治疗]的联合治疗。
其他放射性核素标记FAP-2286也可用于治疗。虽然90Y的β粒子能量比177Lu高,但90Y-β的辐照范围更大,可能会增加骨髓和肾脏毒性的风险。然而,应用较低的剂量可以缓解这一点,如神经内分泌肿瘤的PRRT。α-核素,如225Ac,也是合适的候选者,因为其对肿瘤的传能线密度高且精确,能造成双链DNA断裂。225Ac-FAPI-04(以及64Cu-FAPI-04)在表达FAP的胰腺癌异种移植小鼠模型中的研究表明,FAP-靶向α治疗适用于胰腺癌。FAP-2286的肿瘤半衰期比FAPI-02或FAPI-04长许多,但低于177Lu-PSMA、177Lu-DOTATOC或177Lu-DOTATATE。因此,考虑到177Lu-FAP-2286的有效肿瘤半衰期(平均值:骨转移灶44小时,肝脏单发转移灶32小时),与177Lu或225Ac相比,67Cu或90Y(具有更高β粒子能量的额外优势)等放射性核素可能会增加辐照量。使用这些放射性核素进一步研究有望获益。
本研究的主要局限性是患者人数少且异质性强,所有受试者均为基于姑息治疗而接受177Lu-FAP-2286 PTRT作为最后治疗手段的患者。本研究非剂量梯度研究,不同的177Lu-FAP-2286的放射活性使得安全性和治疗性的评估仅限于观察性。因此,这一回顾性研究令人鼓舞的的初步结果必须由前瞻性、随机和控制变量的临床试验来证实。