近日,一篇发表在红皮杂志International Journal of Radiation Oncology Biology Physics上的文章研究了脑组织对布拉格峰区超高剂量率(uHDR、FLASH)和标准剂量率(SDR)质子照射的反应。研究结果表明在临床前的体内模型中,与SDR相比,uHDR光栅扫描质子照射的可行性被证明可以引起FLASH神经保护作用,即质子束FLASH剂量率布拉格峰区可以保护健康脑组织。
研究背景
超高剂量率(uHDR,FLASH>35 Gy/s)照射已重新成为一种有前途的治疗工具,可保留更多正常组织,同时保持肿瘤控制。FLASH研究主要集中在质子束的剂量学和生物效应观察,主要涉及激光加速和被动散射递送(PSD)。为将质子FLASH放射治疗适用于临床,目前正在改造临床加速器,主要使用PSD和光束调节器进行改造,例如脊形过滤器,可以有效地递送uHDR使单个能量层扩展布拉格峰(SOBP)。对uHDR质子束的体内研究主要集中在正常组织(皮肤和胃肠道)和布拉格峰入口区域的肿瘤反应。尽管,少数研究描述了uHDR电子对脑组织的保护作用,而正常脑组织对uHDR质子布拉格峰区域的反应完全缺失。
为了解决这个问题,本研究健康小鼠大脑对SDR 和uHDR质子布拉格峰区域反应,主要关注DNA和脑微环境放射(表达CD31/PECAM-1和CD68)方面的损伤。通过分析经典DNA双链断裂(DSB)替代标记H2AX在丝氨酸139(γH2AX)上的磷酸化评估DNA损伤,使用血小板内皮细胞黏附分子-1(PECAM-1或CD31)研究脑微血管稳定性。CD31在血管室细胞上表达,可调节血管完整性和免疫细胞运输。CD31的表达可作为描述内皮和血脑屏障(BBB)稳定性的替代指标。BBB/内皮完整性的丧失表现为CD31信号的减少,可作为体内放射损伤的标志。
研究简介
目的
研究脑组织对布拉格峰区超高剂量率(uHDR、FLASH)和标准剂量率(SDR)质子照射的反应。
方法和材料
使用质子束主动扫描uHDR递送,研究布拉格峰区~10 Gy时临床SDR和uHDR之间的剂量率效应(剂量平均线性能量转移[LETD]射程从4.5 keV/µm到10.2 keV/µm)(图1)。通过研究核γH2AX染色(辐射诱导病灶[RIF])、微血管密度和结构完整性(MVD、CD31+内皮细胞)和炎症微环境反应(健康C57BL/6小鼠大脑中的CD68+小胶质细胞/巨噬细胞和高迁移率族蛋白1[HMGB])。
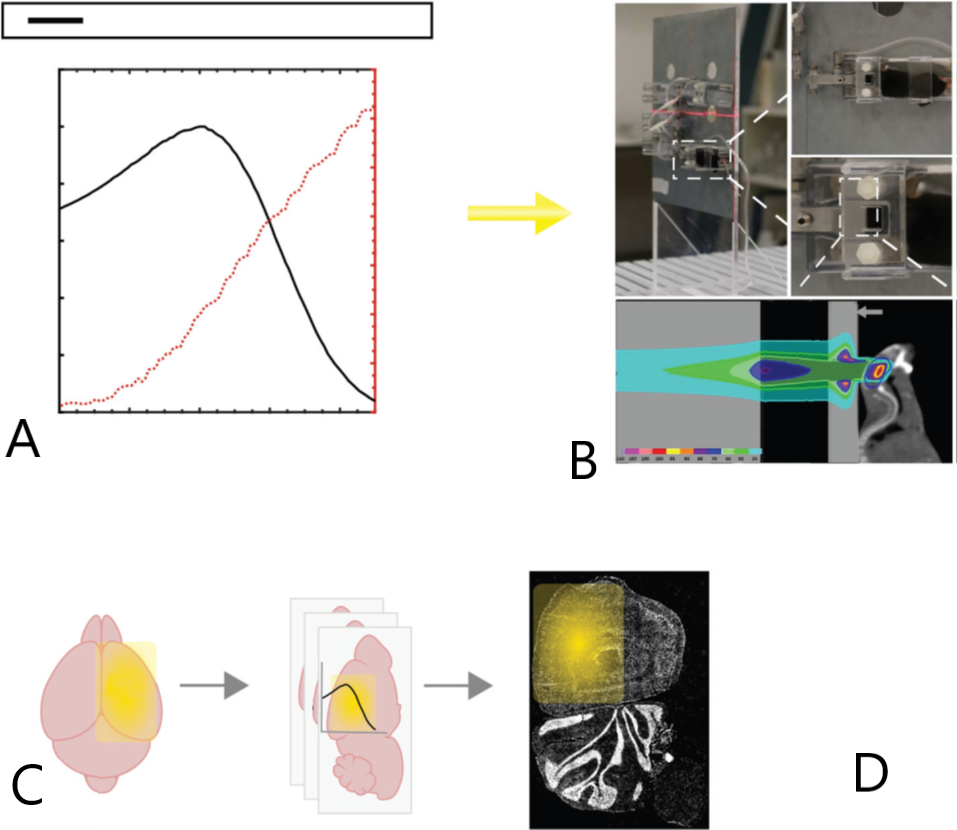
结果
SDR和uHDR的平均剂量率为0.17 Gy/s和120 Gy/s。SDR后RIF阳性细胞的比例增加了~10倍;与SDR比较,uHDR能显著降低RIF阳性细胞的比例 (~2倍,P<0.0001)。此外,与SDR相比,uHDR 基本上可保留微血管结构并减少小胶质细胞/巨噬细胞调节的相关炎症(图2)。
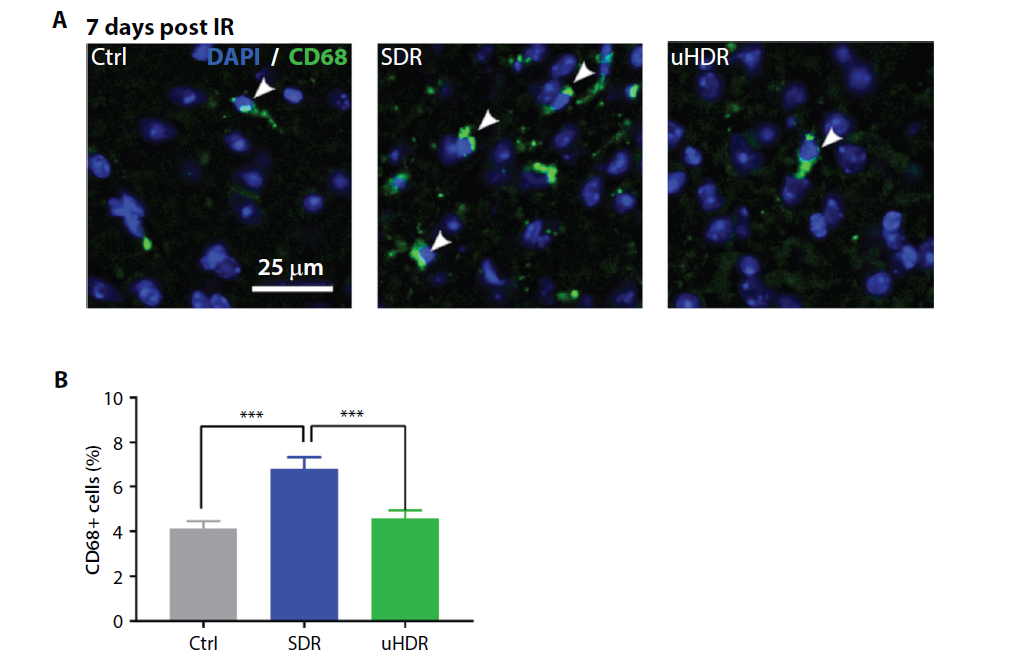
图2. 标准剂量率(SDR)与超高剂量率(uHDR)对炎症反应的影响。(A)小鼠大脑皮层照射后 7 天小胶质细胞/巨噬细胞CD68阳性细胞的代表性图像(放大20倍)。箭头表示 CD68 阳性细胞。(B)7天时每个分析区域 (~500×500 µm2)的CD68+细胞数量。条形代表具有平均值标准误差(SEM)的平均值。
在SDR和uHDR照射后1 h,10 Gy的照射导致H2AX磷酸化的诱导。当比较SDR与uHDR诱导的γH2AX时,uHDR呈现显著的γH2AX信号降低:γH2AX阳性核百分比以及γH2AX总强度降低。照射后第7天,与SDR相比,uHDR照射使γH2AX阳性细胞部分减少了约2.5倍。
结论
在临床前体内模型中,与SDR相比,uHDR光栅扫描质子照射的可行性被证明可以引发FLASH的神经保护作用。此外,这项研究为进一步探索粒子治疗中的高剂量率效应开辟了可能性,可能对临床转化有益,例如,可减少靠近肿瘤靶区布拉格峰区域的正常组织毒性。
据我们所知,这是第一份证明FLASH质子照射在体内的神经保护作用的概念验证报告。需要更长时间的前瞻性随访研究来调查uHDR质子的FLASH保留效应是否能减弱晚期照射诱导的神经毒性。此外,仍需要量化束流递送参数的影响,例如瞬时剂量率、脉冲数、脉冲间间隔和分割方案。