近日,澳大利亚的几位科学家发表在绿皮杂志Radiotherapy and Oncology上的一篇综述从临床挑战,潜在获益和实施途径综合论述了磁共振成像(MRI)引导质子治疗的临床获益。本综述侧重于MRI引导的质子治疗的临床方面,表明MRI引导的质子治疗结合了最佳的癌症靶向与出色的成像。具有大量肿瘤运动和正常器官运动的肿瘤部位将从中获益。通过安全剂量递增或生物适应,质子治疗可提供新的选择,还更新了水平和垂直MRI引导的质子治疗系统的设计和束流建模,以及临床实施策略。
MRI引导质子需要应对解剖变化的挑战
特定部位MRI成像和质子递送能力可以评估和解决解剖的特定变化,并充分利用MRI引导提供的附加信息(表1)。质子计划本质上更难适应解剖变化,因为与光子计划不同,它们通常不具有“移位不变性”(如果束流路径中的解剖改变,束流移动会导致剂量测定变化)。每日适应性重新计划将是解决MRI监测的微小解剖变化的必要条件。对于中枢神经系统和头颈部黏膜癌等运动最小的肿瘤,3D解剖MRI pre-beam以及每日自适应计划能充分掌握治疗前解剖学(包括肿瘤消退和正常器官位置)的日常变化。
表1.不同肿瘤部位MRI引导成像的优势、评估解剖变化的MRI和应对解剖变化的质子递送要求
治疗具有大量运动的肿瘤时,需要进行3D MRI Pre-beam和分次内(实时成像)MRI来监测肿瘤运动。MRI-Linac系统中,MRI引导的自适应立体定向放射治疗的临床工作流程已成功实施于在线Pre-beam和分次内4D MRI。来自MRI-Linac系统的门控经验表明,MRI的实时跟踪和门控能力具有准确的空间完整性和跟踪精度。图像采集和门控回应之间的延迟时间很短,约300~500 ms。MRI-Linac系统的2D cine MRI足以实现门控,实时3D MRI的研究正在进行中。实时跟踪动态治疗递送比门控治疗递送更复杂。质子束的位置需要通过全局移动笔形束扫描传输模式与肿瘤运动的横向变化对齐,需要根据束流路径内解剖变化调整质子能量。然而,三维肿瘤运动时,实时跟踪必须克服主要的技术障碍。2007年发表的粒子治疗实时靶向跟踪结果,考虑了横向靶区位置和深度的变化,为粒子治疗进行实时靶区跟踪的临床实施铺平了道路。缺乏MRI实时靶区位置监测系统,阻碍了质子适应技术的进步。
对于质子治疗的剂量计算和精确靶向来说,解决解剖扭曲以确保几何准确性是必不可少的。然而,在质子治疗中使用CT引导也存在解剖扭曲。光子治疗中CT可提供准确的组织电子密度信息,但CT数值与质子相对阻止本领之间存在不确定性。MRI-Linac系统通过在线扭曲校正克服了几何扭曲问题。调整MRI参数可最小化几何扭曲(例如增加频宽)。MRI引导质子系统也需要类似需求,以确保质子治疗患者解剖学的几何精确度。在MRI引导质子治疗中,需要对从束流入口到肿瘤靶区进行显像,沿束流路径的所有解剖变化都会影响剂量测定。越远离成像中心,图像失真越高,需要纠正这种失真或准确建模整个解剖结构。
MRI引导质子系统设计中的物理挑战
配置选择——磁体设计与剂量之间的影响
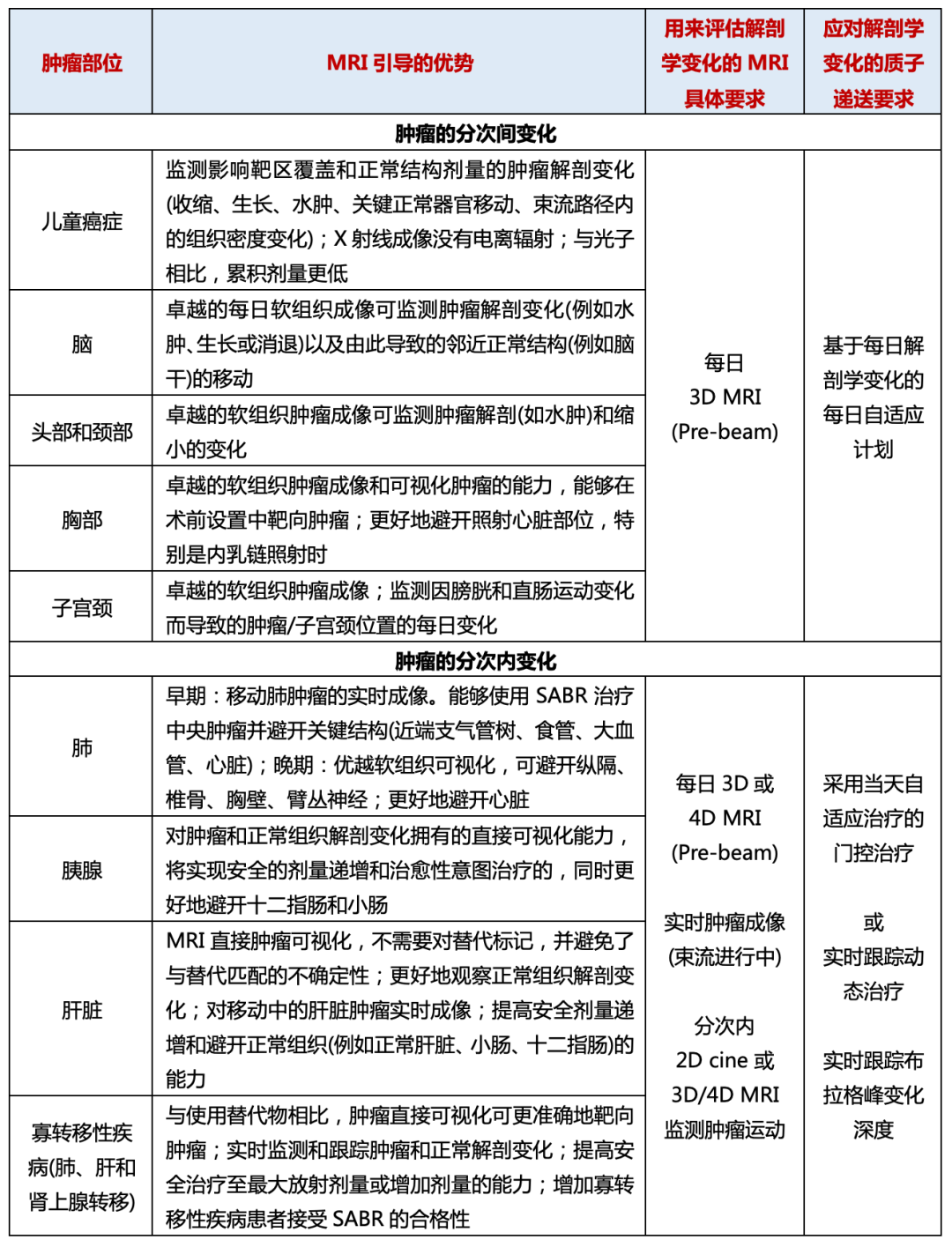
与MRI-Linacs一样,MRI引导质子治疗系统有两种设备配置:水平束和垂直束。图3显示水平固定术和垂直束MRI质子治疗系统。第一个明确要求是质子束要畅通无阻地到达MRI扫描仪内的患者。对于直列定向系统,主要影响是磁铁必须“分开”的程度。患者必须位于磁铁的两个磁极之间,需要在磁铁、梯度线圈和射频线圈中拥有至少50 cm的完整且大的间隔。与更传统的“闭孔”型系统相比,这种MRI配置将更昂贵且性能更低,还需要多个束流角度旋转患者或磁体,两者都具有挑战性。

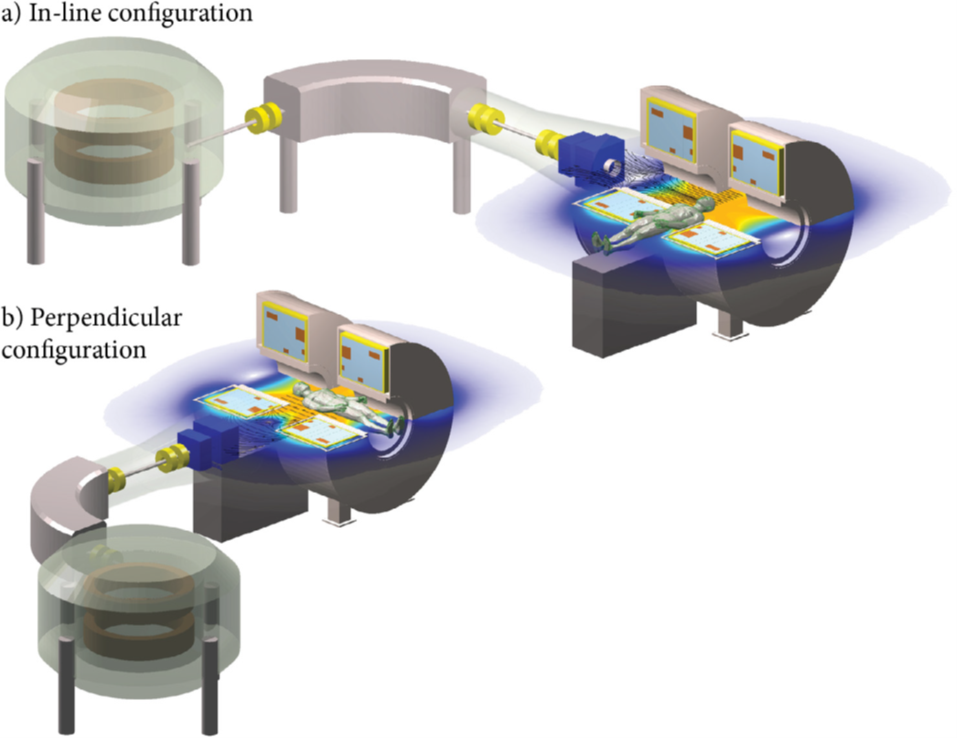
图3.基于澳大利亚MRI-Linac程序磁体设计的通用水平固定束MRI-质子治疗系统示例。还开发了直立患者旋转、机架旋转和垂直系统的选项。箭头表示磁场线,颜色表示磁场大小。a质子束平行于MRI主场的直列系统;b质子束垂直于MRI主场的垂直系统。
更传统的MRI系统几何结构可存在于垂直定向系统中。与MRI-Linac系统相比,MRI质子系统无法采用低温恒温器进行照射,要么完全分开,要么需要一个与旋转磁体或患者结合的“烟囱”。这意味着对于MRI引导质子治疗,无论配置如何,都需要某种形式的开孔磁体(包括梯度线圈和射频线圈)。如上所述,与传统设计相比,这种磁体价格昂贵,尤其是磁场强度较高时。如果采用完全分体方案,分体宽度较直列式系统大幅减小;在70 cm内径磁体中需要30 cm的治疗场,扫描磁体位置在200 cm外时只需要小于20 cm的间隔。
集成MRI放疗设备的第二个要求是精确递送和照射测量。有两个方面限制了这一点。首先,带电粒子传输基本上受磁场的影响。虽然基本物理原理可以用洛伦兹方程很好地解释,但其影响可能既复杂又难以预测。与光子不同,质子本身会受磁场的影响。这意味着磁场不仅会影响患者体内产生二次电子,也受整个束流运输链的影响。质子束流通过已配置垂直和直列系统的1.0 T MRI扫描仪的边界场时,质子束流传输会产生相应影响。在直列场中,质子围绕中心轴旋转,而在垂直场中,束流弯曲远离中心轴,如图4所示。高达1.5 T的直列场可以校正这些影响。除了通过扫描仪边缘场对传输中束流的影响之外,由于质子束的持续扰动和二次电子的影响,对患者体内的剂量沉积也有影响。这些影响已经在一系列场强和配置中得到详细的研究。用于质子治疗的专用剂量算法可以在不影响准确性的情况下显著减少剂量计算时间。磁场对二次电子的影响小于MRI-Linac治疗,粒子束产生的二次电子能量较低,而患者体内质子轨迹的扰动是确定的,可以通过逆向规划来处理。潜在问题是存在解剖学变化会降低计划的准确性,影响可以通过在线自适应策略减轻。
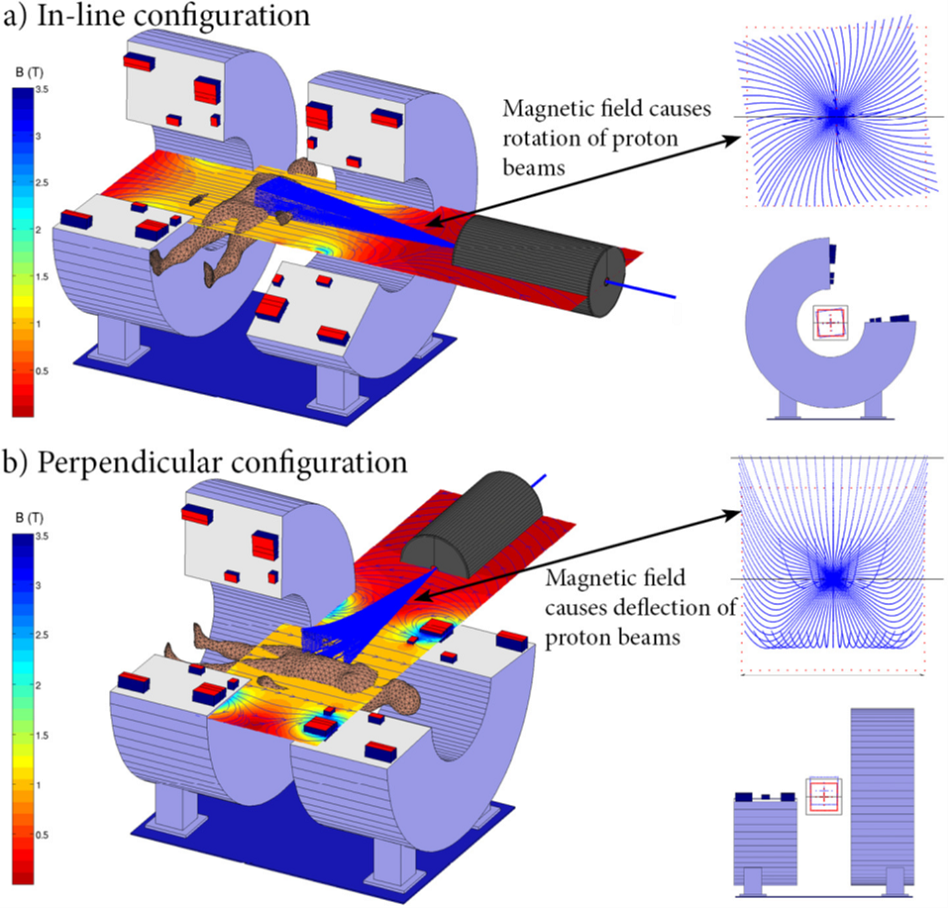
图4. 递送MeV质子束磁场(300 MeV磁场)的水平场(顶部)和垂直场(底部)对束流的影响。在线场导致质子束围绕中心轴旋转;垂直场导致质子束偏转。蓝线显示了发散质子源的束流位置,显示了由磁体边缘场引起的扰动:如果没有磁场,这些将显示为星状直线阵列。
磁铁技术的选择
集成MRI质子系统有几种可行的磁体技术。在MRI-Linacs领域,大多数设备都使用了相当传统的液氦冷却超导磁体。而AuroraRT系统使用由高温超导线圈和铁轭组成的磁铁。“轭”系统的主要优点是磁体的边缘场会大大减小,这往往会减少显像/束流集成的挑战。同时,这种系统的场强限制在0.5 T左右,而且由于铁的磁特性依赖于热,因此显像稳定性较差。此外,与超导空芯系统相比,这种设计似乎对扫描递送系统不断变化的边缘场更敏感。最近,放射领域的供应商已经转向无氦或极低氦的设计。与AuroraRT系统一样,主要优点是它们不需要连接外部环境的淬火管,从而简化了选址和安装。放射肿瘤学有一种历史态度,即更高的场可以更好显像,但现在业界和学术界对高性能、低场MRI(<0.5 T)重新产生了极大的兴趣。
实验进展及现状
目前,已经有两个研究小组进行了MRI引导质子治疗的实验,德国德累斯顿的OncoRay成功地进行了概念系统验证实验。在他们的工作中,将0.22 T铁轭C形MRI与质子笔形束递送系统集成在一起。MRI引导可用于束流递送。德累斯顿小组通过对临床笔形束扫描(PBS)组件联合0.22 T MRI扫描仪进行的实验进一步验证了本研究的可行性。PBS组件产生的边缘磁场,可以观察到伪影。在另一项研究中,OncoRay小组研究了1 T MRI引导质子的电子返回效应。奥地利的MedAustron设施使用1 T磁偶极子系统进行了实验,验证了剂量学变化以及质子束的剂量计划研究。这两项研究中由于磁场的存在,观察到的变化不明显。MedAustron小组还检查了磁场中质子的薄膜响应。海德堡的ARTEMIS小组有一个演示系统,该系统配置一个0.25 T MRI扫描仪,轨道上有一个预想的患者旋转系统。
临床开发和实施策略
本文主要目的是制订一个策略,使MRI引导质子治疗系统可在临床和商业上落实。MRI-Linacs和质子治疗系统都有不断增长的市场。MRI-Linac引导放射治疗系统在2018年收入超过2.2亿美元,预计到2028年为止复合年增长率为20%。全世界有75个粒子治疗中心,另有41个正在建设中,总投资超过100亿美元。用于光子治疗的MRI引导使集成直线加速器系统的成本大约翻了一番,达到约1,000万欧元。质子治疗增加MRI引导的相对额外成本远低于光子治疗。
MRI引导质子治疗的发展离不开临床试验,需要试验来衡量先进技术和研究计划对健康的影响,量化当前和未来的能力。临床试验结果应以非MRI引导的质子治疗和MRI-Linac治疗为基准,估计MRI引导质子治疗的影响。理想情况下,临床试验应采用随机试验的形式,得到MRI引导质子治疗获得临床获益和投资收益的证据,判断是否适用于临床。随机化研究可提供高水平的证据,这些研究应该在临床实施MRI引导质子治疗之前进行,使达到临床平衡的可能性增高。这种方法将避免目前非MRI引导质子治疗的情况,尽管质子治疗在世界范围内使用了十多年,但仍然缺乏随机证据支持。基于注册的临床试验提供了另一种成本较低的获取比较数据的方法,将评估新技术的R-IDEAL框架用于获取临床证据。但是我们应该努力以随机试验和汇总荟萃分析的形式获得1-2级证据。
在德累斯顿和海德堡建造的临床前原型设备,以及德累斯顿临床体系建设的公告,都显示MRI引导质子治疗系统方面取得了进展。这让人十分激动。