本期我们为大家带来质子治疗的PET/CT验证显像。
质子重离子束在人体内具有特殊的深度剂量分布 — 布拉格峰,使得质子重离子束可以近乎理想地实现肿瘤部位的“定点爆破”,对周围正常组织的照射可降到最低。
由于质子重离子束特有的物理和生物学优势,已在全球迅速推广。迄今为止,已有90多个质子重离子治疗中心投入运行,其中大部分为质子治疗中心,并且大约同样数量的治疗中心正在建设或规划中。
在过去的几十年中,加速器技术、束流传输和医学物理学取得了长足的发展,可优化对复杂形状肿瘤区域的剂量传递,并更好地保护周围的正常组织和关键器官。
然而,在临床上充分利用质子重离子束的优势仍面临挑战,尤其是在治疗过程中束流在患者体内射程的不确定性。尽管目前的成像技术可在每个分次治疗前提供SPR(阻止本领比值)估算的容积模型,但临床中依然希望监测并记录实际的治疗情况,以便及时干预出现的误差或在后续分次治疗中进行补偿,因此在这一多学科领域的研究迅速崛起。
2020年德国慕尼黑大学Katia Parodi教授在《British Journal of Radiology》杂志上撰文回顾了质子治疗体内成像最新技术进展与临床应用,其中包括体内质子束射程(剂量)验证与PET显像。从上世纪60年代末的早期研究[1-3]开始, PET仍然是临床上唯一可用的三维、无创、体内监测质子重离子治疗的方法,尤其是监测质子重离子束的射程与范围。
入射质子重离子与人体组织间的相互反应可产生正电子(β+)活化元素(如半衰期为2-20分钟的15O和11C),正电子湮灭辐射产生的511Kev的ϒ射线能进行PET成像。近年来多家治疗中心针对质子治疗的PET验证进行了模型和人体研究,尽管依然面临挑战,但已经体现出PET/CT在此领域的巨大应用前景。
1模型研究
Katia Parodi等[4]采用模型调查了PET/CT用于质子常规治疗验证的可行性,还探讨了PET/CT在有金属植入物存在时的可靠性。研究使用质子束照射不同的模型,这些模型包含聚甲基丙烯酸甲酯(PMMA)、肺与骨等效材料,以及模拟患者植入物的钛棒。质子束照射后20min内行PET/CT显像,并通过GEANT4和FLUKA蒙特卡罗(MC)算法,基于CT图像模拟正电子活化的量和空间分布。
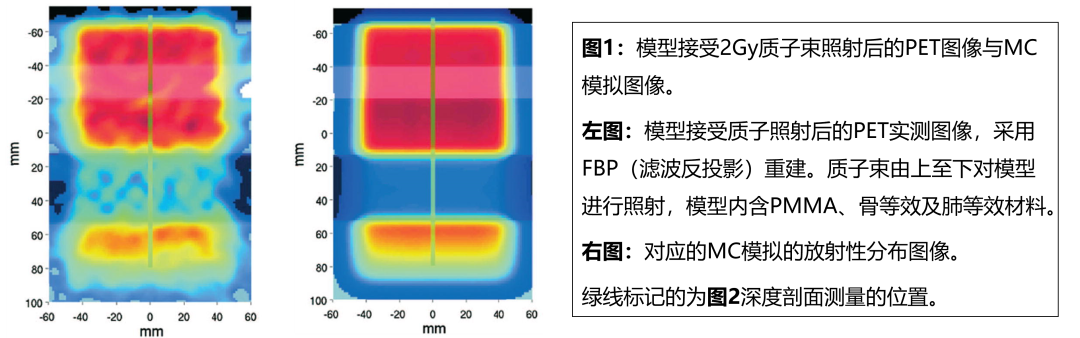
研究表明即使在低治疗剂量照射(2Gy)后,质子射程和照射场位置的PET验证仍具有毫米精度的潜力(图1与图2),且PET在有金属植入物的情况下仍可用于治疗验证。
2021年Fuquan Zhang等[5]通过模拟质子重离子束触发的超低放射性活度,定量分析PET采集的放射性量和空间范围的准确性。质子重离子束触发的正电子放射性属于超低活度(ULA)。因此,为了保证PET临床验证的可靠性,需要评估在ULA情况下PET测量的放射性活度和空间范围的准确性。
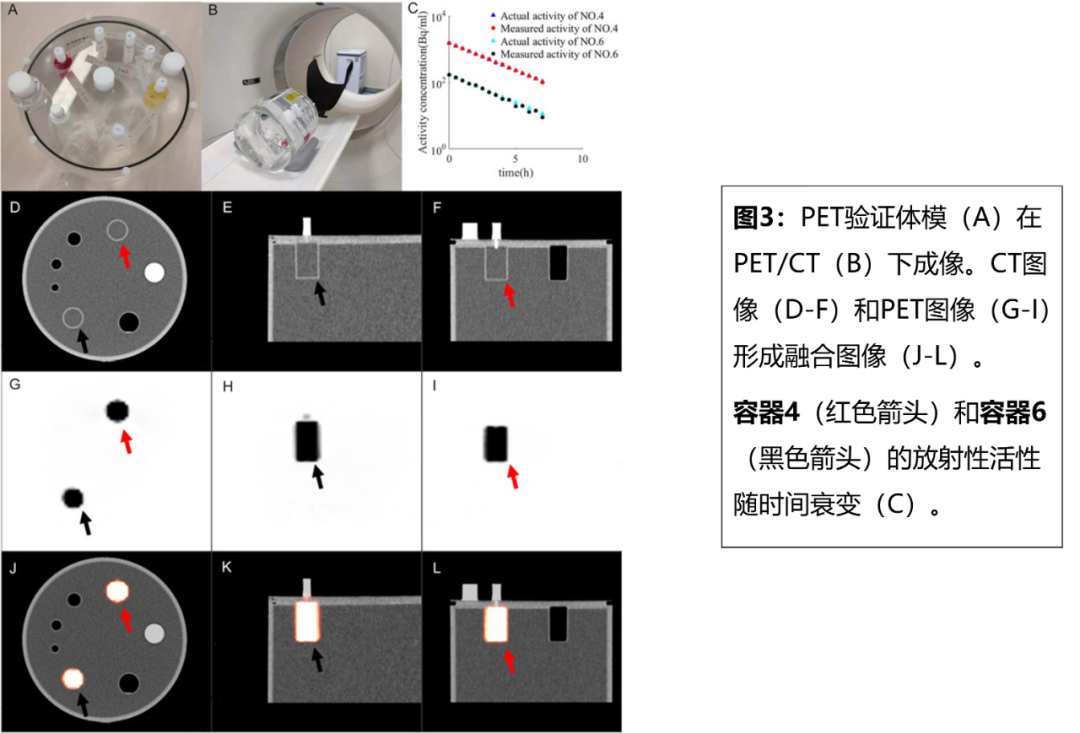
PET验证模型和低放射性18F-FDG用于模拟放射性活度为11.1–1480 Bq/mL的ULA。PET/CT采用SIEMNES Biograph mCT,通过将图像中的放射性与根据衰变函数计算的实际值进行比较,评估PET对ULA放射性定量的准确性,放射性误差容限设置为5%。通过比较放射性分布曲线的宽度与容器的实际宽度,评估PET对ULA空间范围测量的准确性,空间范围误差容限设置为4mm(图3)。
研究表明当ULA的放射性>148 Bq/mL时,放射性误差<5%;当ULA的放射性>30 Bq/mL时,空间范围误差小于4mm,即当质子重离子束触发的放射性活度>148 Bq/mL时,PET可准确量化其放射性量和范围。
2体内研究
Chul Hee Min等[6]纳入9名接受质子治疗的患者,评估同室PET进行治疗验证的可能性,并探索合适的PET扫描时间。所有患者治疗后立即使用同室PET进行扫描,测量PET活性边缘与靶区边缘的距离,并与蒙特卡罗(MC)预测的范围进行比较。
PET实测图像总体上与MC模拟的结果具有良好的空间相关性(图4),一些差异可能与MC预测模型在局部元素成分和生物洗脱方面的不确定性有关;对于8名接受单场治疗的患者,PET实测结果与MC模拟结果之间的平均范围差异小于5 mm(其中有6名患者小于3 mm)。此外,与20分钟的PET扫描相比,5分钟的短PET扫描可以得到类似的效果。

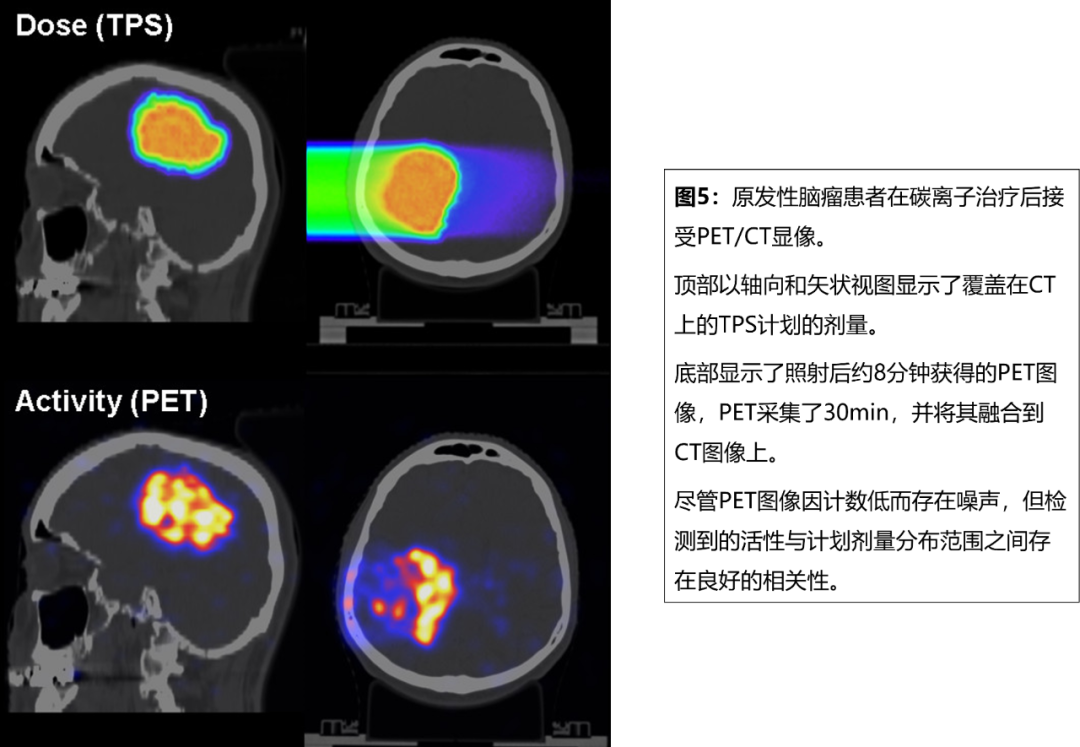
德国海德堡离子束治疗中心也开展了PET/CT验证方面的研究[7],在首例治疗后接受PET/CT显像的患者中发现正电子活性分布范围与TPS剂量分布范围有很好的相关性(图5)。Josefine Handrack等[8]调查了PET/CT对质子分次治疗间变化的敏感性。现代质子重离子束治疗,为肿瘤高度适形提供了非常锐利的剂量梯度。然而,它对组织阻止特性的不确定性、解剖变化、位置错误非常敏感,因此分次治疗间射程验证非常重要。
此研究纳入14名不同适应症的患者在质子束或碳离子束治疗后接受PET/CT监测。除了PET/CT实测外,还在CT数据上模拟了PET活性和剂量分布,然后根据束流路径上的纵向位移对PET数据进行分析。研究发现PET实测和模拟都可以推断出±3mm的分次治疗间的偏移,并且与CT扫描得出的解剖变化有很好的相关性(通常在1.8mm以内)。
3挑战与机遇
由于质子活化的正电子放射性活度很低(比常规PET成像低几个数量级),且半衰期较短,通常需要在治疗结束后尽快进行PET/CT显像,以获取足够的PET计数、提高信噪比及降低生物洗脱的干扰。此外,PET图像需与治疗计划CT精准融合,且需具备足够高的空间分辨率,才能精确验证质子射程。
在质子放疗快速发展的时期,PET/CT在灵敏度、信噪比、空间分辨率、像素分辨率等重要技术领域也取得了长足的进步。西门子多款PET /CT设备曾应用于质子治疗后显像研究,目前全新系列的PET/CT随着性能全面提升,能够更加精确地呈现目标区域的形态和边缘,结合大孔径与TG66标准的放疗成像检查床,能够让PET与治疗计划CT更加精准地配准融合。
PET/CT最新技术突破与先进的质子治疗结合,将为此多学科领域的科研和临床应用带来巨大的机遇!