头颈部肿瘤放疗会造成一定的正常组织损伤,给治疗带来很大的不确定性。相较于传统X线放疗,碳离子束得益于更集中的物理剂量分布,可以更好地保护头颈部正常组织器官,降低副作用。然而,仍然有部分病例会发生明显的急性损伤,如2~3级放射性皮炎。考虑到碳离子束独特的生物学效应,建立基于碳离子束的正常组织并发症概率模型(NTCP),可为毒副反应的个体化评估及碳离子放疗的计划优化提供依据。
NTCP模型可以为临床带来更精准的治疗策略,但是往往需要大样本支持才可以获得较好准确性和稳定性。目前,基于碳离子束的NTCP研究非常有限,该研究首次为头颈部肿瘤碳离子放疗建立了急性放射性皮炎的NTCP模型,为皮肤损伤的评估、计划设计的优化提供了新的参考。
日前,日本群马大学重离子线医学研究中心(Gunma University Heavy Ion Medical Center)医学物理团队开发了基于碳离子放射治疗头颈部肿瘤急性放射性皮炎的NTCP预测模型,该模型可以用来预测头颈部肿瘤急性放射性皮炎(ARD)的发生概率,研究纳入了接受被动散射碳离子放疗的187例头颈部肿瘤患者。原文发表于红皮杂志International Journal of Radiation Oncology Biology Physics。
前言
ARD是放射治疗中常见的副反应,在头颈部肿瘤的治疗中,高达95%的患者发生ARD。严重的ARD会使患者难以耐受,从而影响生活质量,甚至中断治疗。粒子放疗在保护正常组织方面有着明显的优势。然而,一项关于头颈部癌碳离子放疗的Ⅱ期临床试验显示,93%的患者出现了ARD。其中,44%的患者出现了≥2级的ARD(RTOG评分系统)。既往的研究显示,急性放射性皮炎与一系列因素相关,包括自身因素如肥胖、年龄、吸烟状况等,还与治疗因素如皮肤受照射剂量、射线类型以及化疗等密切相关。在这些因素中,剂量-表面直方图(DSH)参数被认为是最重要的预后因子。基于上述因素的NTCP模型也在一些肿瘤放疗中被开发出来并应用于临床。NTCP模型的优势在于,它可以基于每个患者具体的风险因子来预测副反应发生的概率。然而,基于光子或质子的NTCP模型可能并不适用于碳离子放疗,这主要是由于碳离子放疗需要考虑相对生物学效应(RBE)。而RBE本身受到很多因素的影响,并不是恒定值。一些基于细胞及小动物实验的研究结果显示,皮肤的RBE值范围是大概是1.5~3.0。而RBE的临床计算实际上更加复杂,存在很大的不确定性。因此,本文因为生物剂量作为预测参数可能会引入不确定性,在研究中加入了物理剂量与生物剂量的对比分析。
方法
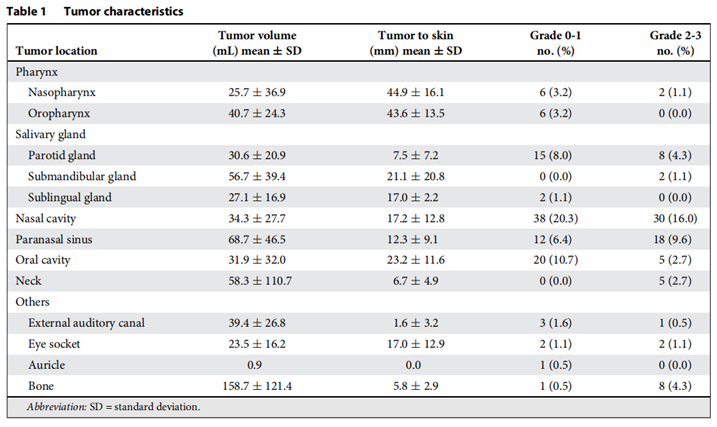
研究人员评估了2010年6月至2020年8月在群马大学重离子线医学研究中心接受被动散射碳离子放疗的187例头颈部肿瘤患者。肿瘤基本特征见表1。放疗处方剂量为57.6~70.4 Gy(RBE)/16次。照射方法为传统的broad beam或者layer-stacking 技术。后者可以提供与靶区更加适形的剂量分布。95%的处方剂量须覆盖全部计划靶体积(PTV),接受60 Gy(RBE)照射的皮肤面积(S60 Gy(RBE))须小于20 cm2。依据肿瘤临床试验(CTCAE)4.0评分体系,分别在每4次放疗后、治疗结束时、治疗后3个月进行皮肤反应评级。整个疗程中,没有患者出现4级或者5级ARD。以放疗开始后90天内的最高评分作为最终结果进行分析。研究者将患者分为两组:Grade 0-1组,Grade 2-3组。后组患者存在明显不适,且与晚期皮肤损伤有关。
表1.入组患者的肿瘤基本特征
研究人员采用了logistic多因素回归分析来建立NTCP模型。纳入的临床因素包括年龄、性别、肿瘤体积、分期、手术、化疗、照射技术等。按照皮肤照射剂量(生物剂量/物理剂量)将患者分为低(5~15 Gy(RBE)/2.5~7.5 Gy)、中(20~35 Gy(RBE)/10~17.5 Gy)、高(40~50 Gy(RBE)/20~25 Gy)三个剂量组。利用10折交叉验证获得每个模型的平均曲线下面积(AUC)值,AUC值越大代表模型分类能力越好,用AICc值判断模型的预测能力,一般其值越低,代表模型预测能力越强。最后综合AUC及AICc值来确定最佳模型。通过上述方法,筛选出每个剂量组表现最好的NTCP模型。然后通过单因素及多因素回归分析筛选独立的临床预测因素,最后通过Spearman关联分析判断剂量因素与临床因素的相关性,进而建立多因素回归模型。最后,AICc值最低且AUC值最高(如果可以)的模型被确定为最终的NTCP模型。
结果
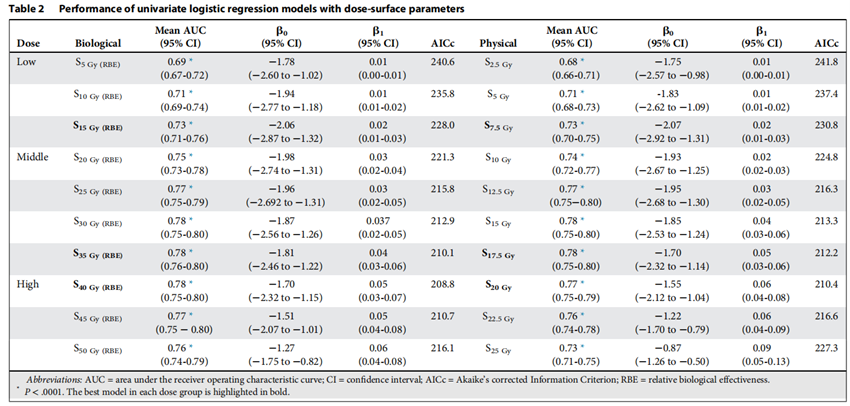
放疗后发生Grade 0-1 ARD107例,发生Grade 2-3 ARD80例。图1展示了不同部位物理剂量及生物剂量分布。ARD与肿瘤距离皮肤的距离、肿瘤的体积及照射技术三个临床因素密切相关。如在鼻腔及副鼻窦肿瘤中,约60%的患者发生了大于2级的ARD。研究者认为PTV到皮肤表面的距离可以作为独立预测因子(AUC:0.76)来判断ARD的发生概率,与其他参数相比,该参数方便测量且准确率高。采用broad beam技术的患者发生Grade 2-3 ARD的风险约是layer-stacking技术的2倍。建议采用layer-stacking或者scanning技术来降低皮肤受量。然而,这些技术能否进一步减少ARD发生概率,仍需进一步研究。在DSH参数中,生物剂量组和物理剂量组在各剂量水平均表现出了较高的一致性(见图3),模型表现相当。其中高剂量组中S40 Gy(RBE)和S20 Gy的模型表现最好,AUC值分别为0.78和0.77,因此被认为是最佳的预测参数。然而,多因素模型并未获得更高的预测能力和准确度,各模型的参数值见表2。
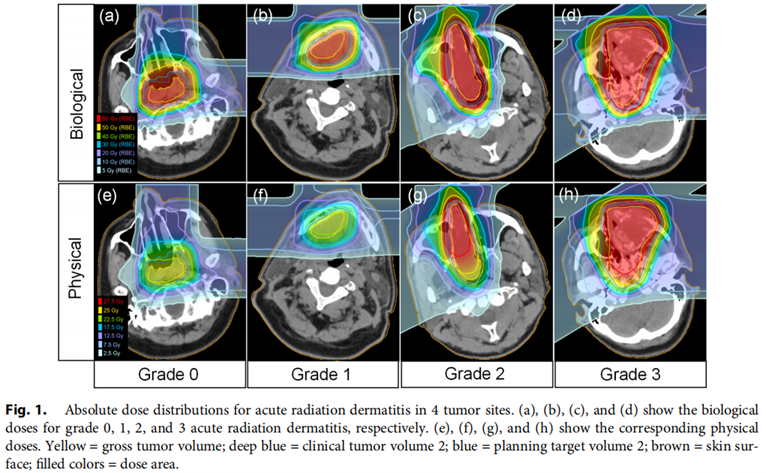
图1.不同部位物理剂量及生物剂量分布
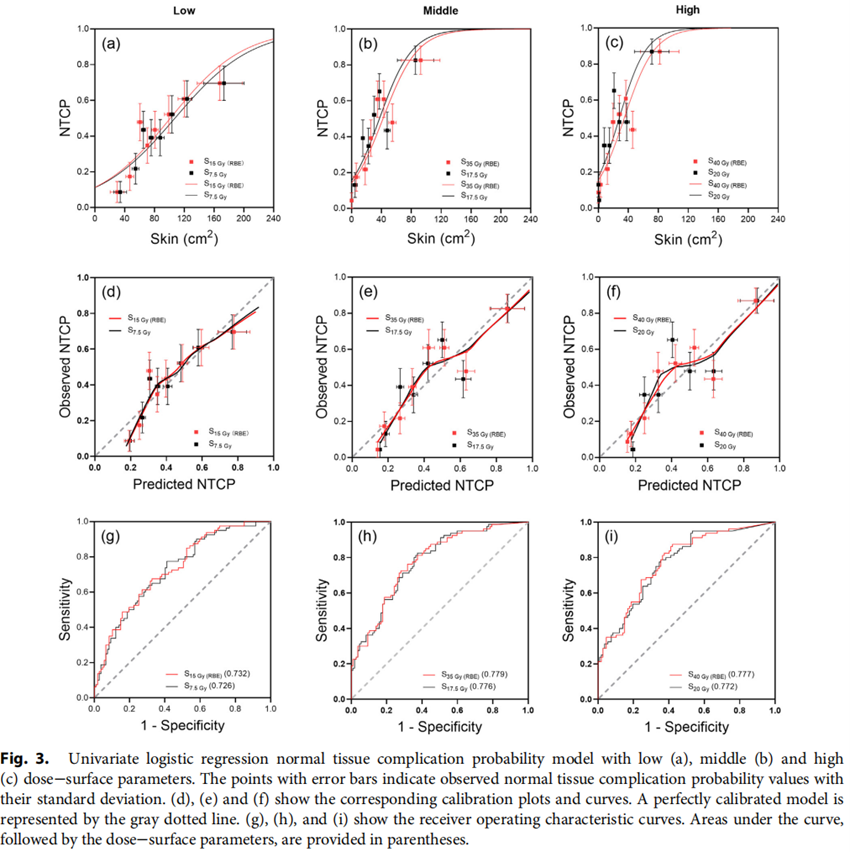
图3.生物剂量组和物理剂量组在各剂量水平NTCP模型比较
表2.各模型的参数值
结论
本研究开发了基于碳离子束的NTCP模型,该模型可以用来预测头颈部肿瘤ARD的发生概率。目的是为优化碳离子放疗计划、皮肤护理等提供临床指导,从而降低毒副反应的发生,为实现个体化碳离子放疗提供重要参考。
同时,作者证实了生物剂量与物理剂量在模型表现中的一致性,这也消减了医生对于生物剂量不确定性的疑虑。然而,该研究同样具有一些局限性,如NTCP模型未经过外部数据的验证、各机构间RBE计算模型存在差异、研究时间跨度较长等。作者给出了相应的解释和解决方法。相较于传统的正常器官剂量限制,NTCP模型可以提供更精准的个体化防护策略,对于碳离子放疗尤为重要。随着碳离子治疗机构的增多,期待多中心研究将进一步验证及改进NTCP模型。