超声分子成像(Ultrasound Molecular Imaging)是利用靶向微泡与血管内皮细胞表面过表达的分子标志物特异性结合以实现其超声成像检测的新技术,在疾病早期诊断与疗效评价方面具有较大的应用前景。然而,由于超声造影成像信号的单色性,传统超声分子成像技术往往只能针对单个靶点进行成像,而在肿瘤等疾病的病变过程中,肿瘤细胞突变往往涉及多个靶标及信号通路在时间和空间上的协同改变,要实现从多个分子事件的网络层面整体把握疾病的恶性状态及进展情况,往往需要在实施分子成像过程中能时空同步地反映这些分子的即时关联与功能状态。为此,研究团队发展了一种基于梯度声压爆破实现双靶点同步超声分子成像的新方法,通过设计不同声压爆破性能的L-MBα和LP-MBv两种靶向微泡(分别靶向αvβ3整合素和VEGFR2血管内皮细胞生长因子受体),静脉注射后使其与各自靶标结合,接着采用不同声压分别对这两种探针进行爆破消除其信号,再借助信号减影的方法分别提取不同探针的超声分子影像信号,从而实现在同一视野对两个靶标的同步分子成像检测。
研究团队测试了L-MBα和LP-MBv两种靶向微泡在水溶液混合条件下的声压爆破性能,发现红色荧光标记的L-MBα在0.65MPa声压条件下可以全部爆破清除,而绿色荧光标记的LP-MBv基本不受影响,采用1.52MPa声压则可以将LP-MBv爆破清除。研究团队将两种混合靶向微泡与血管内皮细胞孵育,使它们一同结合在血管内皮细胞(蓝色)的表面,通过采用0.65MPa声压可以将结合在血管内皮细胞表面的L-MBα选择性爆破,进一步提高声压至1.52MPa则可以将残留的LP-MBv微泡爆破,由此实现了采用梯度声压逐个爆破清除靶向微泡的方法(图1)。
研究团队将该方法应用到乳腺癌荷瘤小鼠双靶点的超声分子影像检测,通过尾静脉同时注射等比例混合的L-MBα和LP-MBv两种靶向微泡,待靶向微泡与肿瘤血管内皮细胞结合后,采用0.65MPa声压爆破清除与肿瘤血管内皮细胞结合的L-MBα,接着提高声压至1.52MPa声压将肿瘤血管内皮细胞结合的LP-MBv爆破清除,通过信号减影分别对第一次和第二次爆破前后的影像信号进行处理,可分别提取出L-MBα和LP-MBv两种靶向微泡的超声分子影像信号(图2)。由于L-MBα和LP-MBv的分子影像信号来自于肿瘤同一视野的相同时刻,由此研究团队成功实现了在活体水平相同视野里乳腺癌肿瘤新生血管内皮细胞整合素αvβ3和VEGFR2的同步超声分子成像检测;通过进一步分析肿瘤不同阶段肿瘤新生血管αvβ3和VEGFR2的超声分子影像信号比值,发现分析αvβ3和VEGFR2的比值比分析单个αvβ3和VEGFR2的表达能更好地反映乳腺癌的恶性状态。
该工作获得了科学技术部重点研发计划项目、国家自然科学基金面上项目、深圳市科技创新委员会以及深圳合成生物学创新研究院等项目的支持。
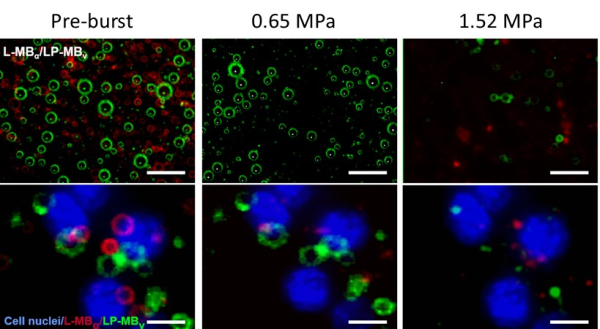
图1 体外L-MBα和LP-MBv靶向微泡在不同声压条件下的爆破清除
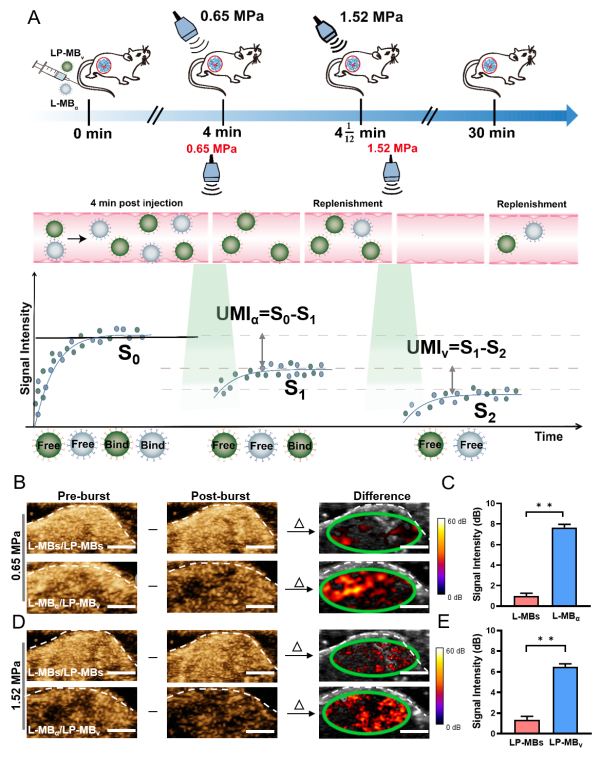
图2 基于梯度声压爆破同步超声分子成像检测αvβ3和VEGFR2的效果